Potassio Yodale (Kio3)
- 2836
- 358
- Silvano Montanari
Cos'è il potassio iodate?
Il potassio o il potassio yodio yodato è un composto di iodio inorganico, in particolare un sale, la cui formula chimica è kio3. Lo iodio o iodio, elemento del gruppo alogeno (F, Cl, Br, I, As), ha in questo sale un numero di ossidazione di +5; Questo è il motivo per cui è un agente ossidante forte. Il kio3 Si dissocia in mezzo acquoso per creare gli ioni K+ e io3-.
È sintetizzato reagendo l'idrossido di potassio con acido yodium: Hio3(aq) + koh (s) => kio3(aq) + h2O (l). Inoltre, può essere sintetizzato reagendo lo iodio molecolare con idrossido di potassio: 3i2(s)+6koh (s) => kio3(aq) + 5ki (aq) + 3h2O (l).
Proprietà Yodale di potassio
 Aspetto di potassio yodio
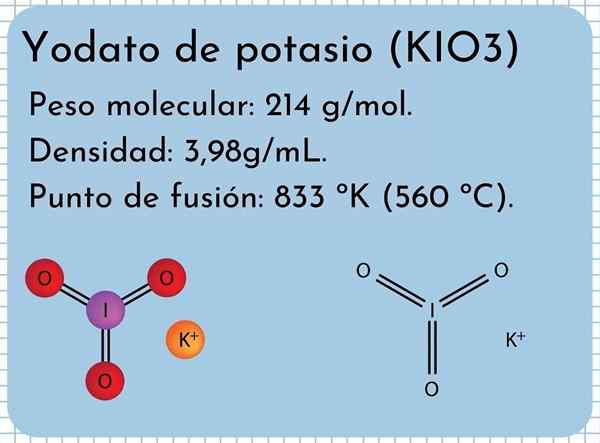
Aspetto di potassio yodio È un solido bianco inodore, cristalli fini e con una struttura cristallina monoclino. Ha una densità di 3,98 g/ml, un peso molecolare di 214 g/mol e presenta bande di assorbimento nello spettro a infrarossi (IR).
Ha un punto di fusione: 833 ºK (560 ºC), costituito da forti interazioni ioniche tra i ioni K+ e io3-. A temperature più elevate, una reazione di decomposizione termica, rilasciando ossigeno molecolare e ioduro di potassio:
2KIO3(s) => 2ki (s) + 3o2(G)
In acqua ha solubilità che variano da 4,74 g/100 ml a 0 ºC, fino a 32,3 g/100 ml a 100 ºC, generando soluzioni acquose incolore. Inoltre, è insolubile in alcol e acido nitrico, ma è solubile in acido solforico diluito.
La sua affinità per l'acqua non è apprezzabile, il che spiega perché non è igroscopico e non esiste sotto forma di sali idratati (KIO3· H2O).
Agente ossidante
Il potassio yodio, come indicato dalla sua formula chimica, ha tre atomi di ossigeno. Questo è un elemento fortemente elettronegativo e, a causa di questa proprietà, lascia "scoperto" una carenza di nuvole elettroniche che circonda lo iodio.
Può servirti: gas inertiQuesta carenza - o contributo, a seconda dei casi, può essere calcolata come il numero di ossidazione dello iodio (± 1, +2, +3, +5, +7), essendo +5 nel caso di questo sale.
Cosa significa questo? Che davanti a una specie in grado di dare i loro elettroni, iodio li accetterà nella loro forma ionica (io3-) per diventare iodio molecolare e avere un numero di ossidazione pari a 0.
Seguendo questa spiegazione, si può determinare che lo iodato di potassio è un composto ossidante che reagisce intensamente con gli agenti riducenti in molte reazioni redox; Di tutti questi, uno è noto come un orologio da iodio.
L'orologio di iodio è costituito da un processo redox di passi lenti e veloci, in cui i passaggi veloci sono contrassegnati da una soluzione Kio3 In acido solforico a cui viene aggiunto l'amido. Quindi, l'amido -una volta prodotto e ancorato tra la sua struttura la specie i3-- Farà la soluzione blu colorata al blu scuro.
Io3- + 3 HSO3- → i- + 3 HSO4-
Io3- + 5 i- + 6 h+ → 3 i2 + 3 h2O
Yo2 + HSO3- + H2O → 2 i- + HSO4- + 2 h+ (blu scuro a causa dell'amido)
Struttura chimica
 Struttura di potassio Yodale
Struttura di potassio Yodale Nell'immagine superiore è illustrata la struttura chimica dello iodate di potassio. L'anione io3- È rappresentato dal "treppiede" di sfere rosse e viola, mentre gli ioni K+ Sono rappresentati da sfere viola.
Ma cosa significano questi treppiedi? Le forme geometriche corrette di questi anioni sono in realtà piramidi trigonali, in cui l'ossigeno costituisce la base triangolare e la coppia non condivisa di iodio punta al piano di sopra, occupando spazio e costringendo a piegare il link i-o e i due collegamenti I = O.
Può servirti: acido tartaricoQuesta geometria molecolare corrisponde a un'ibridazione SP3 dell'atomo centrale dello iodio; Tuttavia, un'altra prospettiva suggerisce che uno degli atomi di ossigeno forma i collegamenti con gli orbitali "d" dello iodio, essendo effettivamente un'ibridazione del tipo SP3D2 (Lo iodio può avere i suoi orbitali "d" che espandono il suo strato di Valencia).
I cristalli di questo sale possono subire transizioni di fase strutturale (altre disposizioni diverse dal monoclino) a seguito delle diverse condizioni fisiche che le sottopongono.
Usi e applicazioni di Iodate di potassio
Uso terapeutico
Il potassio yodato viene solitamente usato per evitare l'accumulo di radioattività nella tiroide sotto forma di 131Io, quando questo isotopo viene utilizzato per determinare lo iodio dalla tiroide come componente del funzionamento della ghiandola tiroidea.
Allo stesso modo, il potassio yodio è usato come antisettico topico (0,5 %) nelle mucose.
Utilizzare nell'industria
Viene aggiunto al cibo degli animali da riproduzione come integratore di iodio. Pertanto, il potassio yodato viene utilizzato nel settore per migliorare la qualità delle farine.
Uso analitico
In chimica analitica, grazie alla sua stabilità, viene utilizzato come modello primario nella standardizzazione dei modelli di tiosolfato di sodio (NA2S2O3), allo scopo di determinare le concentrazioni di iodio nei problemi dei problemi.
Ciò significa che le quantità di iodio possono essere conosciute con tecniche volumetriche (gradi). In questa reazione l'iodato di potassio si ossida rapidamente agli ioni ioduro i-, Attraverso la seguente equazione chimica:
Può servirti: acetato di piombo: struttura, proprietà, ottenimento, usiIo3- + 5i- + 6h+ => 3i2 + 3h2O
Lo iodio, io2, è intitolato con la soluzione NA2S2O3 per la sua standardizzazione.
Utilizzare nella tecnologia laser
Gli studi hanno dimostrato e corroborato le interessanti proprietà ottiche piezoelettriche, piroelettriche, elettrooptiche, ferroelettriche e non lineari dei cristalli di kio3. Ciò si traduce in grandi potenziali nel campo elettronico e nella tecnologia dei laser per i materiali realizzati con questo composto.
Rischi per la salute del yodate di potassio
A dosi elevate può produrre irritazioni nella mucosa orale, nella pelle, negli occhi e nelle vie aeree.
Gli esperimenti della tossicità dell'iodato di potassio negli animali ci hanno permesso di osservare che nei cani in un digiuno, a dosi di 0,2-0,25 g/kg di peso corporeo, fornito per via orale, il composto provoca vomito.
Se questi vomito vengono evitati, produce negli animali un peggioramento della loro situazione, poiché viene indotta un'anoressia e prima della morte. Le sue autopsie hanno permesso di osservare lesioni epatiche necrotiche, reni e mucosa intestinale.
A causa del suo potere ossidante, rappresenta un rischio di incendio quando viene a contatto con materiali infiammabili.
Riferimenti
- Giorno, r., & Underwood, a. Chimica analitica quantitativa (Quinto ed.). Pearson Prentice Hall, P-364.
- Libro chimico. (2017). Iodate di potassio. Estratto il 25 marzo 2018 da Chemicalbook: Chemicalbook.com
- PUBCHEM. (2018). Iodate di potassio. Estratto il 25 marzo 2018 da PubChem: PubChem.NCBI.Nlm.NIH.Gov
- Merck. (2018). Potassio yodato. Estratto il 25 marzo 2018 da Merck:
- Merckmillipore.com
- M M Abdel Kader et al. (2013). Meccanismo di trasporto di carica e transizioni di fase a bassa temperatura in KIO3. J. Phys.: Conf. Essere. 423 012036

