Ossido perclorico (CL2O7)
- 1179
- 24
- Rufo Longo
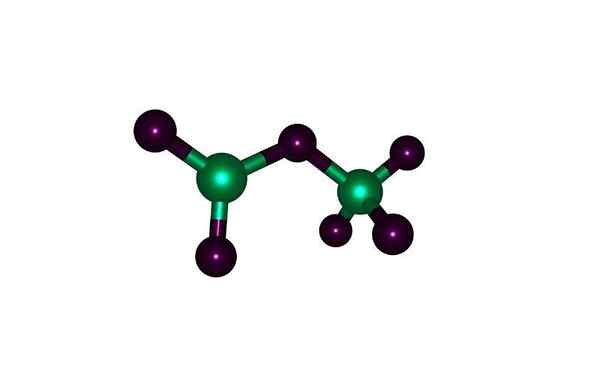
 Barre e sfere di una molecola di ossido perclorico: le sfere verdi sono cloro e ossigeno nero. Con licenza
Barre e sfere di una molecola di ossido perclorico: le sfere verdi sono cloro e ossigeno nero. Con licenza Cos'è l'ossido perlotto?
Lui Ossido percloro, Chiamato anche ossido di cloro (VII), dicloro o eptaxide eptaxide,È un composto chimico inorganico di formula cl2O7, formato da atomi di cloro e ossigeno.
È uno degli ossidi di cloro più stabili e reagisce con l'acqua per produrre acido perclorico:
Cl2O7 + H₂O D 2HCLO4
Il composto è ottenuto dall'attenta disidratazione dell'acido perclorio con pentossido di fosforo a -10 ° C.
2HCLO4 + P2O5 "Cl2O7 + 2HPO3
Il composto viene distillato per separarlo dall'acido metafosforico con grande cautela, data la sua natura esplosiva. Può anche essere formato dall'illuminazione in miscele di cloro e ozono.
Proprietà fisiche e chimiche di ossido percloro
- L'ossido di cloro (VII) è un liquido incolore, volatile e oleoso.
- Il suo peso molecolare è di 182,9 g/mol, la sua densità è 1.900 kg/m³ e i punti di fusione e ebollizione sono rispettivamente -91,57 ° C e 82 ° C.
- È spontaneamente esplosivo per avere un impatto o in contatto con la fiamma, e in particolare in presenza dei suoi prodotti di decomposizione.
- L'eptaossido di cloro si dissolve nel tetracloruro di carbonio a temperatura ambiente e reagisce con l'acqua per formare acido perlorico. Esplodere al contatto con lo iodio.
- In condizioni normali è più stabile, sebbene con meno potenza ossidante rispetto agli altri ossidi di cloro. Ad esempio, non attacca lo zolfo, il fosforo o la carta quando fa freddo.
- L'ettaossido di dicloro è un ossido fortemente acido e in soluzione forma un equilibrio con acido perclorico. I perclorati si formano in presenza di idrossidi metallici alcalini.
- La sua decomposizione termica è prodotta dalla dissociazione monomolecolare di cloro e triossido radicale.
Può servirti: acetato di etileRischi
L'ossido perclorico è un composto instabile. Si decompone lentamente quando conservato, con la produzione di prodotti di decomposizione colorati che sono ossidi di cloro inferiori.
È spontaneamente esplosivo, specialmente in presenza dei suoi prodotti di decomposizione, incompatibile con agenti riducenti, acidi e basi forti.
Sebbene sia l'ossido di cloro più stabile, CL2O7, È un forte ossidante, così come un esplosivo che può essere disattivato con fiamma o shock meccanico, o di contatto con iodio.
Tuttavia, è meno ossidante degli altri ossidi di cloro e non attacca lo zolfo, il fosforo o la carta quando fa freddo. Ha gli stessi effetti sul corpo umano del cloro elementare e richiede le stesse precauzioni.
L'ingestione provoca gravi ustioni in bocca, esofago e stomaco. Il vapore è molto tossico per inalazione.
In caso di contatto visivo, è necessario verificare se vengono utilizzate le lenti a contatto e rimuoverle immediatamente. Gli occhi dovrebbero essere sciacquati con acqua corrente per almeno 15 minuti, mantenendo aperte le palpebre. È possibile utilizzare acqua fredda, senza somministrare unguento per gli occhi.
Se la sostanza chimica entra in contatto con i vestiti, mantienilo il più rapidamente possibile, proteggendo le proprie mani e il proprio corpo. Metti la vittima sotto una doccia di sicurezza.
Se la sostanza chimica si accumula nella pelle esposta della vittima, come le mani, la pelle contaminata da acqua corrente e sapone non abrasiva viene lavata dolcemente e attentamente.
Può essere utilizzata l'acqua fredda. Se l'irritazione persiste, consultare il medico. Lavare i vestiti contaminati prima di usarli di nuovo.
Può servirti: peso equivalenteIn caso di inalazione, la vittima dovrebbe essere autorizzata a stare in un'area ben ventilata. Se l'inalazione è grave, la vittima deve essere evacuata in un'area sicura il più presto possibile.
Vestiti stretti, come il collo, le cinture o la cravatta. Se la vittima è difficile da respirare, l'ossigeno deve essere somministrato.
Se la vittima non respira, viene fatta una rianimazione della bocca. Tenendo sempre conto che può essere pericoloso per la persona che fornisce aiuto per dare la rianimazione a bocca alla bocca quando il materiale inalato è tossico, infettivo o corrosivo.
In tutti i casi, dovrebbero essere cercate cure mediche immediate.
Applicazioni
- L'ossido perclorico non ha applicazioni pratiche. Potrebbe essere usato come agente ossidante o per la produzione di acido perclorico, ma la sua natura esplosiva rende difficile la sua gestione.
- L'ettaossido di dicloro può essere usato come reagente per la produzione di perclorati o per lo studio con reazioni diverse.
- Nel lavoro di Kurt Baum, sono state studiate le reazioni dell'ossido percloro con olefine, alcoli, iodidi di alchil e perclorato di acile con estere, ottenendo alogenitazioni e ossidazioni.
- Nel caso dell'altro, produce alclore reagendo con semplici alcoli come il glicole etilenico, 1, 4-butadienolo, 2, 2, 2-trifluoroetanolo, 2, 2-dinitropropanolololo. Reagisce con il 2-propanolo per dare percelorato isopropilico. 2-esanolo e 3-esanolo danno il pulsante senza accordi e i rispettivi chetoni.
- Il propeno reagisce con l'ettaossido di dicloro nel tetracloruro di carbonio per dare percelorato isopropilico (32%) e 1CLOR, 2-propilperclorato (17%). Il composto reagisce con il Cis-BUNO DARE PERCLORATO 3-CLOLOBUTILE (30%) e 3-ZO, 2-butil percelorato (7%).
Può servirti: struttura cristallina- L'eptaossido di dicloro reagisce con le ammine primarie e secondarie nella soluzione di tetracloruro di carbonio per fornire n-percolati:
2 RNH2 + Cl2O7 → 2 RNHCLO3 + H₂O
2 R2NH + Cl2O7 → 2 R2NCLO3 + H₂O
- Reagisce anche con gli alcheni per dare perplerato alchil. Ad esempio, reagisce con il propeno nella soluzione di tetracloruro di carbonio per produrre isopropil perclorato e perclorato di 1-celle-propil-propil.
Riferimenti
- Egon Wiberg, n. W. (2001). CHIMICA INORGANICA. Academic Press: Londra.
- (2009). EPtooossido di dicloro. Estratto da Chebi: EBI.AC.UK.

