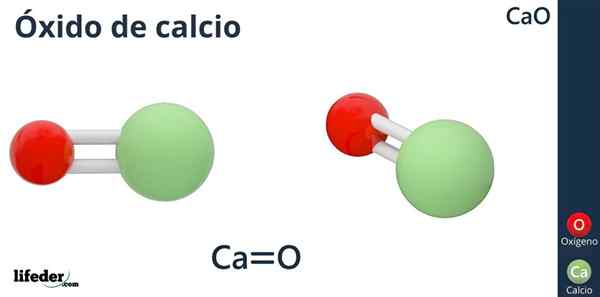
Ossido di calcio (CAO)
- 3548
- 268
- Dante Morelli
Cos'è l'ossido di calcio?
Lui ossido di calcio (CAO) è un composto inorganico che contiene calcio e ossigeno in forme ioniche (non confondere con il perossido di calcio, cao2). Worldly noto come lime, una parola che designa ogni composto inorganico che contiene carbonati, ossidi e idrossidi di calcio, oltre ad altri metalli come silicio, alluminio e ferro.
A questo ossido (o calce) si riferisce anche colloquialmente come vivente o calce, a seconda che sia idratato. La calce vive è ossido di calcio, mentre la calce è il suo idrossido. A sua volta, il calcare (calce o calce indurito) è in realtà una roccia sedimentaria composta principalmente da carbonato di calcio (Caco3).
È una delle maggiori fonti naturali di calcio e costituisce la materia prima per la produzione di ossido di calcio. Come viene prodotto questo ossido? I carbonati sono suscettibili alla decomposizione termica; Il riscaldamento dei carbonati di calcio a temperature superiori a 825 ºC, porta alla formazione di calce e all'anidride carbonica.
L'istruzione precedente può essere descritta come segue: Caco3(s) → Cao (s) + co co2(G). Poiché la crosta terrestre è ricca di calcare e calcite e negli oceani e le spiagge i gusci del mare (materie prime per la produzione di ossido di calcio) sono abbondanti, l'ossido di calcio un reagente relativamente economico.
Formula
La formula chimica dell'ossido di calcio è CAO, in cui il calcio è come lo ione acido (accettore elettronico) CA2+, e ossigeno come lo ione di base (donatore di elettroni) o2--.
Perché il calcio ha una carica +2? Perché il calcio appartiene al gruppo 2 della tabella periodica (SR. Scholambara) e ha solo due elettroni di valenza disponibili per la formazione di collegamenti, che produce all'atomo di ossigeno.
Può servirti: ossido di potassio (K2O)Struttura dell'ossido di calcio
 Struttura cristallina di ossido di calcio
Struttura cristallina di ossido di calcio La struttura cristallina (tipo di sale gemma) per ossido di calcio è rappresentata nell'immagine superiore. Le sfere rosse voluminose corrispondono agli ioni Ca2+ e sfere bianche agli ioni o2-.
In questa disposizione cristallina cubica ogni ione ca2+ è circondato da sei ioni o2-, Occulato nei buchi ottaedrici lasciati da grandi ioni tra loro.
Questa struttura si esprime al massimo il carattere ionico di questo ossido, sebbene la notevole differenza di radio (la sfera rossa è più grande del bianco) gli conferisce un'energia reticolare cristallina più debole rispetto al MGO.
Proprietà dell'ossido di calcio
 Aspetto dell'ossido di calcio
Aspetto dell'ossido di calcio Fisicamente, è un solido bianco cristallino, un bagno e con forti interazioni elettrostatiche, che sono responsabili dei loro alti punti di fusione (2572 ºC) e di ebollizione (2850 ºC). Inoltre, ha un peso molecolare di 55.958 g/mol e l'interessante proprietà di essere termoluminescenti.
Ciò significa che un pezzo di ossido di calcio esposto a una fiamma può brillare con una luce bianca intensa, conosciuta in inglese con il nome RIBALTA, o in spagnolo, luce di calcio. Gli ioni ca2+, In contatto con il fuoco, hanno origine una fiamma rossastra, come si può vedere nella seguente immagine.
 Luce di calcio o luci della ribalta
Luce di calcio o luci della ribalta Solubilità
Il CAO è un ossido di base che ha una forte affinità per l'acqua, a tal punto che assorbe l'umidità (è un solido igroscopico), reagendo immediatamente per produrre idrossido spento o calcio:
Cao (s) + h2O (l) => ca (oh)2(S)
Questa reazione è esotermica (rinuncia al calore) a causa della formazione di un solido con interazioni più forti e una rete cristallina più stabile. Tuttavia, la reazione è reversibile se la ca (OH) viene riscaldata2, disidratazione e illuminazione della calce; Quindi, il lime "rinato".
Può servirti: safranina: caratteristiche, uso, tecniche, tossicitàLa soluzione risultante è molto semplice e se satura di ossido di calcio raggiunge un pH di 12,8.
Allo stesso modo, è solubile in glicerolo e soluzioni acide e zuccherate. Come è un ossido di base, ha naturalmente interazioni efficaci con ossidi acidi (SIO2, Al2O3 e fede2O3, Ad esempio) essendo solubile nelle fasi liquide di essi. D'altra parte, è insolubile negli alcoli e nei solventi biologici.
Usi/applicazioni
CAO ha un vasto innumerevoli usi industriali, nonché nella sintesi di acetilene (CH≡CH), nell'estrazione di fosfati delle acque reflue e nella reazione con il biossido di zolfo delle bevande analcoliche.
Di seguito sono descritti altri usi dell'ossido di calcio:
Come mortaio
Se l'ossido di calcio viene miscelato con sabbia (SIO2) e acqua, torte con la sabbia e reagisce lentamente con l'acqua per formare calce opaco. A sua volta, co2 Dall'aria si dissolve nell'acqua e reagisce con il sale per formare carbonato di calcio:
Ca (Oh)2(s) + co2(g) => caco3(s) + H2O (l)
Il caco3 È un composto più resistente e duro del CAO, causando indurirsi il mortaio (la miscela precedente) e riparare i mattoni, i blocchi o le ceramiche tra loro o sulla superficie desiderata.
Nella produzione di vetro
La materia prima essenziale per la produzione di vetro è gli ossidi di silicio, che sono miscelati con calce, carbonato di sodio (NA2Co3) e altri additivi, e quindi sottoposti a riscaldamento, risultando in un solido vetroso. Questo solido viene successivamente riscaldato e soffiato in qualsiasi figura.
Nel mining
La calce noiosa occupa un volume maggiore rispetto alla calce vivente a causa delle interazioni da parte dei ponti idrogeno (O-H-O). Questa proprietà è sfruttata per rompere le rocce dai suoi considera.
Può servirti: idrogenazione cataliticaCiò si ottiene riempiendoli con una miscela compatta di calce e acqua, che è sigillata per focalizzare il suo calore e il suo potere espansivo all'interno della roccia.
Come agente di rimozione silicati
Il CAO si fonde con i silicati per formare un liquido coalescente, che viene quindi estratto dalla materia prima da un determinato prodotto.
Ad esempio, i minerali di ferro sono la materia prima per la produzione di ferro e acciaio metallici. Questi minerali contengono silicati, che sono impurità indesiderate per il processo e sono eliminati con il metodo recentemente descritto.
Nanoparticelle di ossido di calcio
L'ossido di calcio può essere sintetizzato come nanoparticelle, diverse concentrazioni di nitrati di calcio (CA (NO3)2) e idrossido di sodio (NaOH) in soluzione.
Queste particelle sono sferiche, di base (così come la scala da solida a macro) e hanno molta superficie. Di conseguenza, queste proprietà beneficiano i processi catalitici. Quale? Le indagini stanno attualmente rispondendo a questa domanda.
Queste nanoparticelle sono state usate per sintetizzare composti organici sostituiti - come derivati dalla piridina - nella formulazione di nuovi farmaci per eseguire trasformazioni chimiche come la fotosintesi artificiale, per la purificazione dell'acqua da metalli pesanti e dannosi e come agenti fotocatalitici.
Le nanoparticelle possono essere sintetizzate sul supporto biologico, come le foglie di papaia e tè verde, per dare loro l'uso come agente antibatterico.
Riferimenti
- Scifun.org. (2018). Calce: ossido di calcio. Recuperato da: Scifun.org.
- Wikipedia. (2018). Ossido di calcio. Recuperato da: in.Wikipedia.org
- PUBCHEM. (2018). Ossido di calcio. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- SHIVER & ATKINS. (2008). Chimica inorganica. In Gli elementi del gruppo 2. (quarta edizione., P. 280). Mc Graw Hill.