Ossido di zolfo
- 2030
- 328
- Benedetta Rinaldi
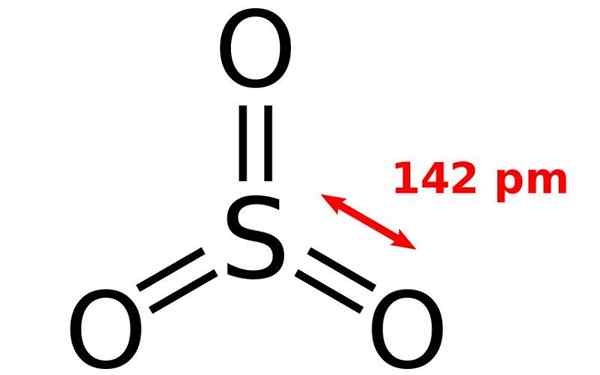
 Struttura chimica della molecola di ossido di zolfo. Fonte: Joel Holdsworth, Wikimedia Commons
Struttura chimica della molecola di ossido di zolfo. Fonte: Joel Holdsworth, Wikimedia Commons Cos'è l'ossido di zolfo?
Lui ossido di zolfo (Vi), noto anche come triossido di anidride solforica, è un composto chimico di formula S3, Questo, in condizioni normali, è un solido incolore e fibroso, e a 25 ° C e 1 atm è un potente agente inquinante, responsabile della pioggia acida.
Il triossido di zolfo è prodotto dall'ossidazione dell'ossido di zolfo.
Fino ad ora, tuttavia, l'unica preparazione di triossido di zolfo puro dai gas contenenti3 diluito, è stato un processo su scala pilota di piante che implica la condensa crioscopica.
La normale procedura implica, invece, una distillazione del petrolio. Il calore richiesto per la distillazione dell'olio viene fornito in modo più comodo mediante gas a contatto a caldo dall'impianto di acido solforico associato.
Può essere preparato in laboratorio riscaldando l'acido solforico del fumo e raccogliendo sublimati in un ricevitore raffreddato. Se il vapore è condensato sopra i 27 ° C, la forma gamma è ottenuta come liquido.
Se il vapore è condensato al di sotto di 27 ° C e in presenza di una linea di umidità, si ottiene una miscela delle tre forme. Le 3 forme possono essere separate dalla distillazione frazionaria.
La combustione del combustibile fossile è la causa del suo aspetto nell'atmosfera, questa è la principale causa antropogenica.
Proprietà fisiche e chimiche dell'ossido di zolfo
- La triossido di zolfo è a forma di aghi bianchi che diventano fumo nell'aria. Spesso incontri inibitori per evitare la polimerizzazione.
Può servirti: Renio: scoperta, proprietà, struttura, usi- Il suo peso molecolare è di 80.066 g/mol, la sua densità è di 1,92 g/cm³ g/ml e i punti di fusione e ebollizione sono rispettivamente di 16,8 ° C e 44,7 ° C.
- Il composto è combinato con acqua con forza esplosiva, formando acido solforico a causa della sua acidità. Sostanze organiche di triossido di zolfo Carboniza.
- Il triossido di zolfo assorbe rapidamente l'umidità, emettendo fumi bianchi densi. Le soluzioni di triossido di acido solforico sono chiamate acido solforico o olio.
- La reazione al triossido di zolfo e l'ossigeno diffluoruro sono molto vigorosi e vengono prodotte esplosioni se la reazione viene eseguita in assenza di un solvente.
- La reazione in eccesso di triossido di zolfo con tetrafluoroetilene provoca la decomposizione esplosiva di fluoruro carbonilico e biossido di zolfo.
- La reazione dell'acido perclorico anidro con triossido di zolfo è violenta ed è accompagnata dall'evoluzione del calore considerevole. Il triossido di zolfo liquido reagisce violentemente con cloruro di nitrile, anche 75 ° C.
- La reazione al triossido di zolfo e l'ossido di piombo provoca luminescenza bianca. La combinazione di iodio, piridina, zolfo e triossido di formamide ha sviluppato un gas sulla pressurizzazione dopo diversi mesi.
Ciò è dovuto alla lenta formazione di acido solforico, acqua esterna o disidratazione della formamide idrogeno cianuro.
Rischi
La triossido di zolfo è un composto stabile, incompatibile con materiali organici, metalli finemente in polvere, basi, acqua, cianuri e un'ampia varietà di altri prodotti chimici.
La sostanza è un forte ossidante e reagisce violentemente con materiali e organizzatori combustibili e composti organici che causano pericolo di incendio e esplosione.
Può servirti: ossalato di sodio (Na2c2o4): struttura, proprietà, usi, rischiReagisce violentemente con acqua bagnata e aria per produrre acido solforico. La soluzione in acqua è un forte acido, reagisce violentemente con basi e metalli corrosivi, formando gas infiammabile / esplosivo.
Il composto è corrosivo per metalli e tessuti. Provoca ustioni negli occhi e nella pelle. L'ingestione provoca gravi ustioni in bocca, esofago e stomaco. Il vapore è molto tossico per inalazione.
In caso di contatto visivo, è necessario verificare se vengono utilizzate le lenti a contatto e rimuoverle immediatamente. Gli occhi dovrebbero essere sciacquati con acqua corrente per almeno 15 minuti, mantenendo aperte le palpebre. È possibile utilizzare acqua fredda, senza applicare unguento per gli occhi.
Se la sostanza chimica entra in contatto con i vestiti, mantienilo il più rapidamente possibile, proteggendo le proprie mani e il proprio corpo. Metti la vittima sotto una doccia di sicurezza.
Se la sostanza chimica si accumula nella pelle esposta della vittima, come le mani, la pelle contaminata da acqua corrente e sapone non abrasiva viene lavata dolcemente e attentamente. Può essere utilizzata l'acqua fredda. Se l'irritazione persiste, consultare il medico. Lavare i vestiti contaminati prima di usarli di nuovo.
In caso di inalazione, la vittima dovrebbe essere autorizzata a stare in un'area ben ventilata. Se l'inalazione è grave, la vittima deve essere evacuata in un'area sicura il più presto possibile. Vestiti stretti, come il collo, le cinture o la cravatta.
Se la vittima è difficile da respirare, l'ossigeno deve essere somministrato. Se la vittima non respira, viene fatta una rianimazione della bocca. Tenendo sempre conto che può essere pericoloso per la persona che fornisce aiuto per dare la rianimazione a bocca alla bocca quando il materiale inalato è tossico, infettivo o corrosivo.
Può servirti: acido pituitario (H3PO2): proprietà, usi e reagentiIn tutti i casi, dovrebbero essere cercate cure mediche immediate.
D'altra parte, l'inquinamento atmosferico dovuto agli ossidi di zolfo è un importante problema ambientale, con milioni di tonnellate di anidride solforosa e triossido emesse nell'atmosfera ogni anno. Questi composti sono dannosi per la vita vegetale e animale, nonché per molti materiali da costruzione.
Un altro grosso problema da considerare è la pioggia acida. Entrambi gli ossidi di zolfo si dissolvono nelle gocce d'acqua atmosferiche per formare soluzioni acide, che possono essere molto dannose quando cadono sotto forma di pioggia.
La pioggia acida può danneggiare le foreste e far morire i pesci in molti laghi. È anche corrosivo per metalli, calcare e altri materiali. Le possibili soluzioni a questo problema sono costose a causa della difficoltà di eliminare lo zolfo di carbone e petrolio prima di bruciare.
Applicazioni
- Il triossido di zolfo è un reagente essenziale nelle reazioni di solfonazione. Questi processi forniscono detergenti, coloranti e prodotti farmaceutici. Viene generato in situ dall'acido solforico o usato come soluzione di acido solforico di fumo.
- Le sue proprietà disinfettanti sono responsabili per i secoli da utilizzare per disinfettare i cubi del vino, bruciando lo zolfo al loro interno.
Riferimenti
- Triossido Sulphur. Recuperato da EBI.AC.UK
- Triossido di zolfo dei dati di sicurezza di sicurezza. Recuperato da Sciencelab.com

