Volume atomico
- 4516
- 989
- Zelida Gatti
Cos'è il volume atomico?
Lui Volume atomico È un valore relativo che indica la relazione tra la massa molare di un elemento e la sua densità. Quindi, questo volume dipende dalla densità dell'elemento e la densità dipende dalla fase e dal modo in cui gli atomi sono ordinati in questo.
In modo che il volume atomico per un elemento z non sia lo stesso in un'altra fase diversa da quella che presenta a temperatura ambiente (liquido, solido o gas) o quando fa parte di alcuni composti. Pertanto, il volume atomico di Z nel composto ZB è diverso dalla z nel composto ZB.
Perché? Per capirlo è necessario confrontare gli atomi con, ad esempio, alcuni marmi. I marmi hanno il loro bordo materiale molto ben definito, che si osserva grazie alla loro brillante superficie. D'altra parte, il bordo degli atomi è diffuso, sebbene possano essere considerati remotamente sferici.

Pertanto, ciò che determina un punto oltre il bordo atomico è la probabilità vuota di trovare un elettrone, e questo punto può essere più o più vicino al nucleo a seconda di quanti atomi vicini interagiscono attorno all'atomo in considerazione.
Volume atomico e radio
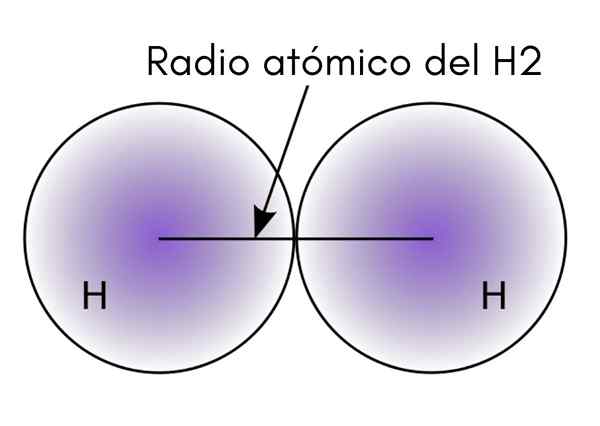
Quando si interagiscono due atomi H nella molecola H2, Le posizioni dei loro nuclei sono definite e le distanze tra loro (distanze internucleari). Se entrambi gli atomi sono sferici, il raggio è la distanza tra il nucleo e il bordo diffuso:

Nell'immagine superiore si può vedere come la probabilità di trovare un elettrone diminuisce mentre si allontana dal nucleo. Dividi per due la distanza internucleare, si ottiene il raggio atomico. Quindi, assumendo una geometria sferica per gli atomi, la formula viene utilizzata per calcolare il volume di una sfera:
V = (4/3) (pi) r3
Può servirti: combustibilitàIn questa espressione r è il raggio atomico determinato per la molecola H2. Il valore V calcolato con questo piccolo metodo preciso può cambiare se, ad esempio, viene considerata h2 in stato liquido o metallico. Tuttavia, questo metodo è molto impreciso perché le forme di atomi sono molto lontane dalla sfera ideale nelle loro interazioni.
Per determinare i volumi atomici nei solidi, sono prese in considerazione molte variabili relative all'accordo e che sono ottenute da studi di diffrazione di raggi X.
Formula aggiuntiva
La massa molare esprime la quantità di materia che ha una mole di atomi di un elemento chimico.
Le sue unità sono g/mol. D'altra parte, la densità è il volume che occupa un grammo dell'elemento: g/ml. Poiché le unità del volume atomico sono ml/mol, devi giocare con le variabili per raggiungere le unità desiderate:
- (g/mol) (ml/g) = ml/mol
O qual è lo stesso:
- (Massa molare) (1/d) = V
- (Massa molare/d) = v
Pertanto, il volume di una mole di atomi di un elemento può facilmente calcolare; mentre con la formula del volume sferico viene calcolato il volume di un singolo atomo.
Per raggiungere questo valore dal primo, è necessaria una conversione attraverso il numero Avogadro (6,02 · 10-23).
Come varia il volume atomico nella tabella periodica?
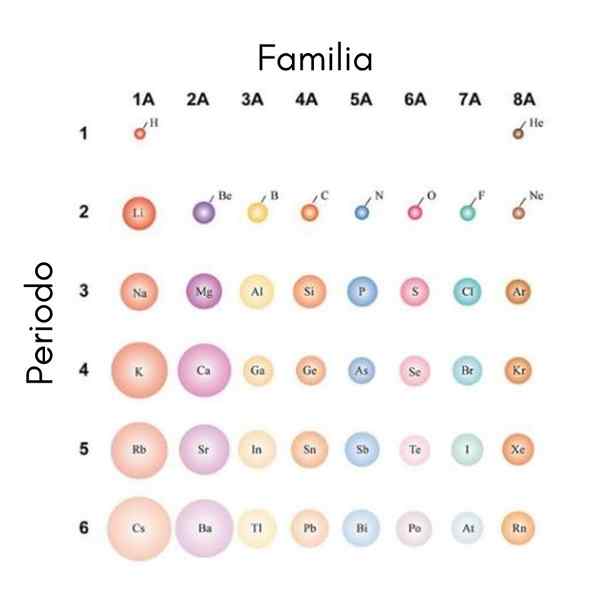
Se gli atomi sono considerati sferici, la loro variazione sarà la stessa che si osserva nelle radio atomiche. Nell'immagine superiore, che mostra gli elementi rappresentativi, è illustrato che da destra a sinistra gli atomi nani; D'altra parte, dall'alto verso il basso questi diventano più ingombranti.
Questo perché nello stesso periodo il core incorpora i protoni mentre si sposta a destra. Questi protoni esercitano una forza di attrazione su elettroni esterni, che sentono un'efficace carico nucleare zEf, Minore della vera carico nucleare z.
Può servirti: disposizione: struttura, proprietà, ottenimento, usiGli elettroni degli strati interni respingono quelli dello strato esterno, riducendo l'effetto del nucleo su di essi; Questo è noto come effetto schermo. Nello stesso periodo l'effetto dello schermo non riesce a contrastare l'aumento del numero di protoni, in modo che gli elettroni dello strato interno non impediscano la contrazione degli atomi.
Tuttavia, quando si discosta in un gruppo, sono abilitati nuovi livelli di energia, che consentono agli elettroni di orbitare il nucleo. Allo stesso modo, il numero di elettroni nello strato interno è aumentato, i cui effetti di protezione iniziano a diminuire se il nucleo aggiunge di nuovo i protoni.
Per questi motivi è apprezzato che il gruppo 1A abbia gli atomi più voluminosi, a differenza dei piccoli atomi del gruppo 8A (o 18), quello dei gas nobili.
Volumi atomici di metalli di transizione
Gli atomi di metalli di transizione incorporano elettroni in orbitali interni d. Questo aumento dell'effetto dello schermo e, così come la vera caricamento nucleare z, sono quasi ugualmente annullati, quindi i loro atomi mantengono dimensioni simili nello stesso periodo.
In altre parole: in un periodo, i metalli di transizione presentano volumi atomici simili. Tuttavia, queste piccole differenze sono enormemente significative quando si definiscono i cristalli di metallo (come se fossero marmi metallici).
Esempi di volume atomico
Sono disponibili due formule matematiche per calcolare il volume atomico di un elemento, ciascuno con i suoi esempi corrispondenti.
Esempio 1
Dato il radiogrogeno atomico -37 pm (1 picometro = 10-12m) -e il cesio -265 pm-, calcola i volumi atomici.
Può servirti: benzaldeideUsando la formula del volume sferico, allora hai:
VH= (4/3) (3.14) (37 pm)3= 212.07 pm3
VCs= (4/3) (3.14) (265 pm)3= 77912297.67 pm3
Tuttavia, questi volumi espressi in picometri sono esorbitanti, quindi si trasformano in unità di angstrom, moltiplicandole per il fattore di conversione (1Å/100pm)3:
(212.07 pm3) (1å/100pm)3= 2.1207 × 10-4 A3
(77912297.67 pm3) (1å/100pm)3= 77.912 Å3
Pertanto, le differenze di dimensioni tra il piccolo atomo H e l'atomo voluminoso di CS sono evidenziate numericamente. È necessario tenere conto del fatto che questi calcoli non sono altro che approssimazioni in base all'affermazione che un atomo è totalmente sferico, che divide la realtà.
Esempio 2

La densità dell'oro puro è di 19,32 g/ml e la sua massa molare è 196,97 g/mol. Applicando la formula M/D per calcolare il volume di una mole di atomi d'oro, quanto segue è:
VAu= (196,97 g/mol)/(19,32 g/ml) = 10,19 ml/mol
Cioè, che 1 mol di atomi d'oro occupa 10,19 ml, ma quale volume occupa specificamente un atomo d'oro? E come esprimerlo nelle unità PM3? Per questo, basta applicare i seguenti fattori di conversione:
(10,19 ml/mol) · (mol/6.02 · 10-23 atomi) · (1 m/100 cm)3· (1 pm/10-12M)3= 16,92 · 106 p.m3
D'altra parte, il raggio atomico dell'oro è 166 pm. Se entrambi i volumi vengono confrontati - quello ottenuto dal metodo precedente e che viene calcolato con la formula del volume sferico - si scoprirà che non hanno lo stesso valore:
VAu= (4/3) (3.14) (166 pm)3= 19,15 · 106 p.m3
Quale dei due è più vicino al valore accettato? Quello che è più vicino ai risultati sperimentali ottenuti dalla diffrazione di raggi X della struttura cristallina dell'oro.

