Volatilizzazione

- 2814
- 629
- Zelida Gatti
 Quando l'acqua viene riscaldata in una piastra fino a quando non si verifica il vapore, si verifica la volatilizzazione. Con licenza
Quando l'acqua viene riscaldata in una piastra fino a quando non si verifica il vapore, si verifica la volatilizzazione. Con licenza Cos'è la volatilizzazione?
IL volatilizzazione È il processo di conversione di una sostanza chimica di uno stato liquido o solido in un gassoso o di vapore. Altri termini usati per descrivere lo stesso processo sono la vaporizzazione, la distillazione e la sublimazione.
Una sostanza può spesso essere separata da un'altra mediante volatilizzazione e può essere recuperata mediante condensazione del vapore.
La sostanza può essere volatilizzata più rapidamente, riscaldandola per aumentare la pressione del vapore o cottura a vapore, usando un flusso di gas inerte o una pompa a vuoto.
Le procedure di riscaldamento comprendono la volatilizzazione dell'acqua, del mercurio o del tricloruro di arsenico per separare queste sostanze dagli elementi interferenziali.
A volte vengono utilizzate reazioni chimiche per produrre prodotti volatili, come nel rilascio di anidride carbonica dai carbonati, ammoniaca nel metodo Kjeldahl per la determinazione dell'azoto e dell'anidride dello zolfo nella determinazione dello zolfo in acciaio.
I metodi di volatilizzazione sono generalmente caratterizzati da grande semplicità e facilità di funzionamento, tranne quando sono altamente resistenti alla corrosione resistente o ai materiali.
Volatilizzazione della pressione di vapore
Sapendo che la temperatura di ebollizione dell'acqua è a 100 ° C, è pertinente chiedere perché l'acqua piovana evapora. Se è a 100 ° C, dovrebbe darci calore.
Vale anche la pena chiedere cosa dà l'aroma caratteristico a alcol, aceto, legno o plastica.
La persona responsabile di tutto ciò è una proprietà nota come pressione del vapore, che è la pressione esercitata da un vapore in equilibrio con la fase solida o liquida della stessa sostanza. Inoltre, la pressione parziale della sostanza nell'atmosfera sul solido o sul liquido.
La pressione del vapore è una misura della tendenza di un materiale da cambiare nello stato gassoso o vapore, ovvero una misura della volatilità della sostanza.
Può servirti: disolfuro di carbonio (CS2): struttura, proprietà, usi, rischiAll'aumentare della pressione del vapore, maggiore è la capacità del liquido o del solido di evaporare, essendo così più volatile.
La pressione del vapore aumenterà con la temperatura. La temperatura alla quale la pressione del vapore sulla superficie di un liquido è uguale alla pressione esercitata dall'ambiente è chiamata punto di ebollizione del liquido.
La pressione del vapore dipenderà dal soluto disciolto in soluzione (è una proprietà coligativa). Sulla superficie della soluzione (interfaccia aria-bassa), le molecole più superficiali tendono a evaporare, scambiandosi tra fasi e generazione della pressione del vapore.
La presenza di soluto riduce il numero di molecole di solvente all'interfaccia, riducendo la pressione del vapore.
La variazione della pressione del vapore può essere calcolata con la legge di Raault per soluti non volatili, che è dato da:
(1)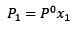 Dove P1 è la pressione del vapore dopo aver aggiunto il soluto, x1 è la frazione molare di detto soluto e p ° è la pressione di vapore del solvente puro.
Dove P1 è la pressione del vapore dopo aver aggiunto il soluto, x1 è la frazione molare di detto soluto e p ° è la pressione di vapore del solvente puro.
Se la somma delle frazioni molari del soluto e del solvente è uguale a 1, allora abbiamo:
(2)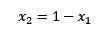
Dove x2 è la frazione molare del solvente. Se moltiplichiamo entrambi i lati dell'equazione per p °, allora rimane:
(3)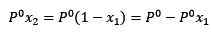
Sostituire (1) in (3) rimane:
(4)
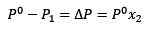
Questa è la variazione della pressione del vapore quando un soluto si dissolve.
Analisi gravimetrica
L'analisi gravimetrica è una classe di tecniche di laboratorio utilizzate per determinare la massa o la concentrazione di una sostanza misurando un cambiamento di massa.
Il chimico che stiamo cercando di quantificare è talvolta chiamato analita. Potremmo usare l'analisi gravimetrica per rispondere a domande come:
Può servirti: minerali di metallo- Qual è la concentrazione dell'analita in una soluzione?
- Quanto è puro il nostro campione? Il campione qui potrebbe essere solido o in soluzione.
Esistono due tipi comuni di analisi gravimetrica. Entrambi comportano il cambiamento della fase dell'analita per separarla dal resto di una miscela, dando origine a un cambiamento nell'impasto.
Uno di questi metodi è la gravimetria delle precipitazioni, ma quella che ci interessa davvero è la gravimetria della volatilizzazione.
La gravimetria della volatilizzazione si basa sul campione termico o chimicamente e misura il cambiamento risultante nella sua massa.
In alternativa, possiamo catturare e pesare un prodotto volatile di decomposizione. Poiché il rilascio di una specie volatile è una parte essenziale di questi metodi, li classifichiamo collettivamente come metodi di analisi della volatilizzazione gravimetrica.
I problemi di analisi gravimetrica sono semplicemente problemi di stechiometria con alcuni passaggi aggiuntivi.
Per eseguire qualsiasi calcolo stechiometrico, abbiamo bisogno dei coefficienti dell'equazione chimica bilanciata.
Ad esempio, se un campione contiene impurità di bario diidratato (Bacl2● H₂O), è possibile ottenere la quantità di impurità che riscaldano il campione per evaporare l'acqua.
La differenza di massa tra il campione originale e il campione riscaldato ci darà, nei grammi, la quantità di acqua contenuta nel cloruro di bario.
Con un semplice calcolo stechiometrico, verrà ottenuta la quantità di impurità del campione.
Distillazione frazionata
La distillazione frazionaria è un processo attraverso il quale i componenti di una miscela liquida sono separati in diverse parti (chiamate frazioni) in base ai loro diversi punti di ebollizione.
La differenza di volatilità dei composti della miscela svolge un ruolo fondamentale nella sua separazione.
Può servirti: regola degli ottettiLa distillazione frazionaria viene utilizzata per purificare le sostanze chimiche e anche per separare le miscele e ottenere i loro componenti. È usato come tecnica di laboratorio e nel settore, dove il processo ha una grande importanza commerciale.
I vapori di una soluzione bollente vengono passati lungo una colonna alta, chiamata colonna di suddivisione.
La colonna è ricca di perle di plastica o di vetro per migliorare la separazione, fornendo più superficie per la condensa ed evaporazione.
La temperatura della colonna diminuisce gradualmente lungo la sua lunghezza. I componenti con un punto di ebollizione più elevato sono condensati nella colonna e tornano alla soluzione.
I componenti dei punti di ebollizione inferiori (più volatili) passano attraverso la colonna e vengono raccolti vicino alla parte superiore.
Teoricamente, avere più perle o piastre migliora la separazione, ma l'aggiunta di piastre aumenta anche il tempo e l'energia necessari per completare una distillazione.
Esempi di volatilizzazione
- Un blocco di ghiaccio secco a contatto con un scoppio d'aria. L'aria inizia il processo di volatilizzazione e il ghiaccio sta evaporando: passa dallo stato solido al soda.
- Quando viene bollita l'acqua o l'altra sostanza: il calore genera vapore e quindi l'acqua passa dallo stato liquido al gassoso.
- Le pillole di naftalina, che gradualmente si degradano e passano dallo stato solido al soda.
- Quando lo zolfo solido è sottoposto a temperature elevate, diventa gas tossici. Cioè, va da solido a gassoso.
- Pillole aromatizzanti: hanno lo stesso processo delle pillole di naftalina, gradualmente si degradano e diventano gas, odorosi e innocui.
Riferimenti
- Definizione della pressione vapore. Recuperato da Thoughtco.com.
- Pressione del vapore. Recuperato dalla Britannica.com.

