Transaminazione
- 871
- 87
- Silvano Montanari
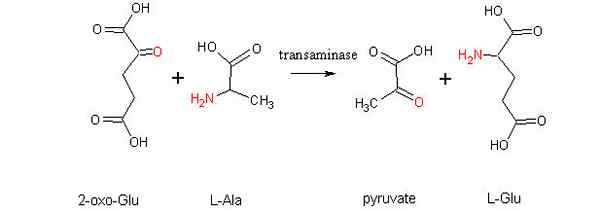
 Schema di una reazione di aminotransfert tra un aminoacido e un alfa-zoacido (fonte: alcibiadi via Wikimedia Commons)
Schema di una reazione di aminotransfert tra un aminoacido e un alfa-zoacido (fonte: alcibiadi via Wikimedia Commons) Cos'è la transaminazione?
IL transaminazione È un tipo di reazione chimica che funziona nella "ridistribuzione" dei gruppi di aminoacidi, poiché circonda i processi reversibili di aminazione (aggiunta di un gruppo amminico) e crepacuore (eliminazione di un gruppo amminico), che sono catalizzati da enzimi specifici noto come transaminasi o aminotransferasi.
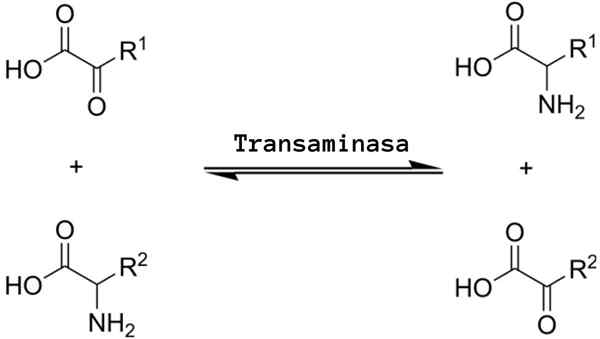
La reazione di transaminazione generale implica lo scambio tra un aminoacido e qualsiasi α-ZO-spot, in cui lo scambio di un gruppo amminico produce la versione ketoacida del primo aminoacido substrato e la versione aminoacid.
Il gruppo amminico che di solito viene scambiato è l'ammino "alfa", cioè quello che partecipa alla formazione dei collegamenti peptidici e che definisce la struttura degli aminoacidi, sebbene le reazioni che coinvolgono altri gruppi amminici presenti in diverse posizioni in Posizioni diverse possono verificarsi in.
Ad eccezione di lisina, treonina, prolina e idrossiprolina, tutti gli aminoacidi partecipano a reazioni di transaminazione, sebbene per istidina, serina, metodo e fenilalanina siano state descritte transaminasi, ma le loro rotte metaboliche non implicano questo tipo di reazioni.
Le reazioni di transaminazione tra aminoacidi e α-cetoacidi furono scoperte nel 1937 da Braunstein e Kritzmann e da allora sono state soggette a studi intensi, poiché si verificano in molti tessuti diversi e con scopi diversi.
Nell'uomo, ad esempio, le transaminasi sono ampiamente distribuite nei tessuti corporei e sono particolarmente attivi nel tessuto muscolare cardiaco, nel fegato, nel tessuto muscolare scheletrico e nei reni.
Meccanismo di reazione
Le reazioni di transaminazione implicano più o meno lo stesso meccanismo. Come accennato in precedenza, queste reazioni si verificano come uno scambio reversibile di un gruppo amminico tra un aminoacido e un α-zo-cid.
Può servirti: materiali in ceramica: caratteristiche, tipi, esempiQueste reazioni dipendono da un composto noto come fosfato piridossale, un derivato della vitamina B6 che partecipa come trasportatore di gruppi amminici e che si lega agli enzimi transaminasi attraverso la formazione di una base Schiff tra il gruppo aldeide di questa molecola e l'amino ε di un residui di lisina sul sito attivo dell'enzima.
L'unione tra il fosfato piridossale e il residuo di lisina sul sito attivo non è covalente, ma viene data attraverso l'interazione elettrostatica tra il carico positivo di azoto nella lisina e il carico negativo nel gruppo fosfato del piridossale.
Nel corso della reazione, l'amminoacido che funziona come un substrato sposta il gruppo ε-amino del residuo di lisina nel sito attivo che partecipa alla base Schiff con il piridoxal.
Nel frattempo, una coppia di elettroni di carbonio alfa aminoacidi vengono rimossi e trasferiti sull'anello di piridina che compone il fosfato piridoxal (con una carica positiva) e quindi vengono "consegnati" a α-zid che funziona come un secondo substrato.
In questo modo, il fosfato piridossale non solo partecipa al trasferimento o al trasporto degli aminoacidi tra gli aminoacidi e gli α-ecotoacidi che sono substrati delle transaminasi, ma agisce anche da "affondare", facilitando la dissociazione della dissociazione l'idrogeno acido alfa.
In sintesi, il primo substrato, un aminoacido, trasferisce il suo gruppo amminico al fosfato piridossale, da cui viene successivamente trasferito al secondo substrato, un α-zootoide, che forma, nell'intermedio, un composto intermedio noto come piridoxamina fosfato.
Può servirti: cromatografia a colonnaFunzione di transaminazione
Gli enzimi transaminasi si trovano generalmente in citosol e mitocondri e lavorano nell'integrazione di diversi percorsi metabolici.
Il glutammato deidrogenasi nella sua reazione inversa, ad esempio, può trasformare il glutammato in ammonio, NADH (o NADPH) e α-zetoglutarato, che può entrare nel ciclo degli acidi tricarbossilici e nella produzione di energia.
Questo enzima, che si trova nella matrice mitocondriale, rappresenta un punto di ramo che associa gli aminoacidi al metabolismo energetico, in modo che quando una cellula manca di energia sufficiente sotto forma di carboidrati o grassi per funzionare, può usare alternativamente alcuni aminoacidi per lo stesso scopo.
La formazione dell'enzima (glutammato deidrogenasi) durante lo sviluppo del cervello è essenziale per il controllo della disintossicazione da ammonio, poiché è stato dimostrato che alcuni casi di ritardo mentale hanno a che fare con una bassa attività, che porta all'accumulo di ammonio, Il che è dannoso per la salute del cervello.
In alcune cellule epatiche le reazioni di transaminazione possono anche essere utilizzate per la sintesi di glucosio di gluconeogenesi.
La glutammina viene convertita in glutammato e ammonio dall'enzima glutaminasi. Quindi, il glutammato viene convertito in α-zetoglutarato, che entra nel ciclo di Krebs e quindi in gluconeogenesi. Quest'ultimo passo si verifica grazie a Malo, uno dei prodotti sulla rotta, viene trasportato al di fuori dei mitocondri per mezzo di una navetta.
Questa navetta lascia α-clutarato in balia dell'enzima di Málica, che lo rende piruvato. Due molecole di piruvato possono essere convertite, quindi una molecola di glucosio attraverso la gluconeogenesi.
Può servirti: pallone di sfondo piattoEsempi
Le reazioni di transaminazione più comuni sono correlate agli aminoacidi alanina, all'acido glutammico e all'acido aspartico.
Alcuni enzimi aminotransferasi possono, oltre al fosfato piridossale, usare il piruvato come "coenzima", come nel caso del glutammato-piruvato transaminasi, che catalizza la seguente reazione:
glutammato + piruvato ↔ alanina + α-cetoglutarato
Le cellule muscolari dipendono da questa reazione per produrre alanina dal piruvato e per ottenere energia attraverso il ciclo di Krebs mediante α-zetoglutorato. In queste cellule l'uso di alanina come fonte di energia dipende dall'eliminazione dei gruppi amminici come ioni di ammonio nel fegato, attraverso il ciclo dell'urea.
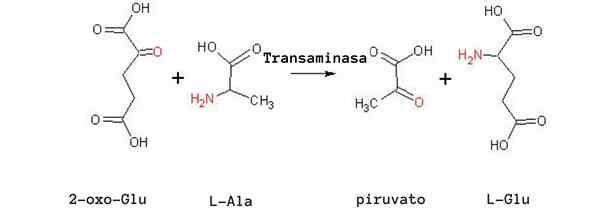 Reazione di transaminazione alanina (Fonte: Tomas Drab [Public Domain] tramite Wikimedia Commons)
Reazione di transaminazione alanina (Fonte: Tomas Drab [Public Domain] tramite Wikimedia Commons) Un'altra reazione di transaminazione molto importante in diverse specie è quella catalizzata dall'enzima aspartato aminotransferasi:
L-SPARTO + α-chetoglutarato ↔ Oxalacetato + L-glutammato
Infine, ma non meno importante, la reazione di transaminazione dell'acido γ-aminobutirrico (GABA), un aminoacido non proteico per il sistema nervoso centrale che funziona come un neurotrasmettitore inibitorio. La reazione è catalizzata da un acido transaminasi γ-aminobutirico ed è più o meno come segue:
α-chetoglutarato + acido 4-aminobutanoico ↔ glutammato + semi-auto succinica
Il semi -uso succinico è convertito in acido succinico da una reazione di ossidazione e quest'ultimo può entrare nel ciclo di Krebs per la produzione di energia.

