Ziehl-neelsen colorazione
- 1754
- 369
- Kayla Serr
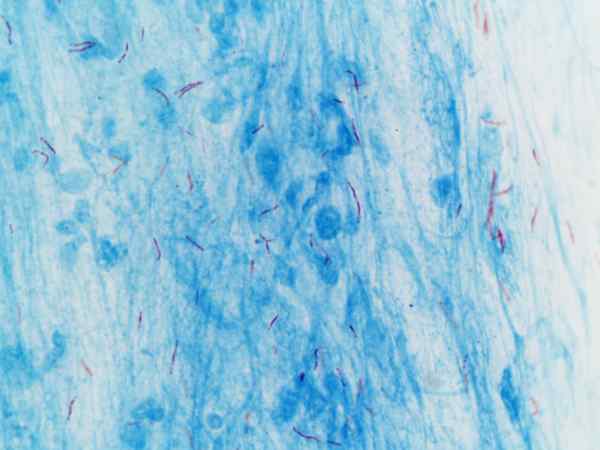
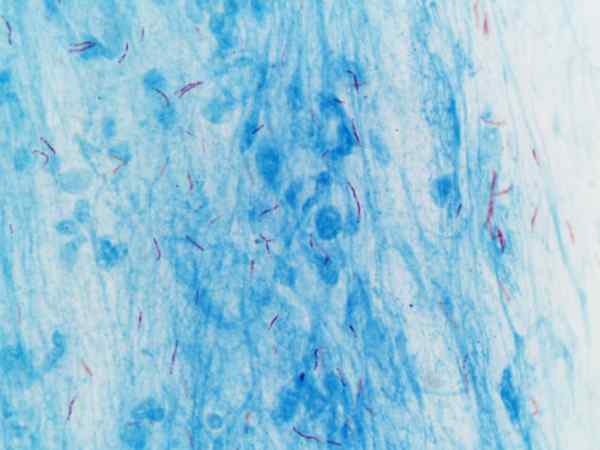 Mycobacterium tuberculosis visualizzata con colorazione di Ziehl-neelsen
Mycobacterium tuberculosis visualizzata con colorazione di Ziehl-neelsen Cos'è la colorazione di Ziehl-Neelsen?
IL Ziehl-neelsen colorazione In una tecnica da colorare per identificare microrganismi resistenti alcol-acido (AAR). Il nome di questa procedura di microbiologia si riferisce ai suoi autori: il batteriologo Franz Ziehl e il patologo Friedrich Neelsen.
Questa tecnica è un tipo di colore differenziale, che implica l'uso di coloranti diversi al fine di creare contrasto tra le strutture che si desiderano osservare, differenziare e successivamente identificare. La colorazione di Ziehl-Neelsen serve a identificare alcuni tipi di microrganismi.
Alcuni di questi microrganismi sono micobatteri (ad esempio, Mycobacterium tuberculosis), Nocardia (per esempio, Nocardia sp.) e alcuni parassiti unicellulari (per esempio, Cryptosporidium parvum). Molti dei batteri possono essere classificati attraverso una tecnica comune chiamata colorazione Gram.
Tuttavia, alcuni gruppi batterici richiedono altri metodi per identificarli. Tecniche come la colorazione Ziehl-Neelsen richiedono combinazioni di calore con calore per fissare il primo alla parete cellulare.
Quindi arriva un processo di scolorimento che consente di ottenere due risultati: resistenza o sensibilità all'acido e agli alcoli.
Base
Il fondamento di questa tecnica di colorazione si basa sulle proprietà della parete cellulare di questi microrganismi. Il muro è formato da un tipo di acidi grassi chiamati acidi micolici; Questi sono caratterizzati dalla presentazione di catene molto lunghe.
Quando gli acidi grassi hanno strutture molto lunghe, queste possono trattenere i coloranti più facilmente. Alcuni generi di batteri sono molto difficili da tingere dalla colorazione Gram, a causa dell'elevato contenuto di acidi micolici dalla parete cellulare.
Nella colorazione Ziehl-Neelsen, viene utilizzato il composto fenolico di carboli di fucsin, un colorante di base. Questo ha la capacità di interagire con gli acidi grassi della parete cellulare, che è di consistenza cerosa a temperatura ambiente.
Può servirti: monosaccaridiLa colorazione con carbola fucsin è migliorata in presenza di calore, perché la cera si scioglie e le molecole da colorare si muovono più rapidamente nella parete cellulare.
L'acido usato in seguito serve a scolorire le cellule che non erano tinte perché la loro parete non era correlata al colorante; Pertanto, la forza dell'acido acido è in grado di eliminare il colorante acido. Le cellule che resistono a questo scolorimento sono chiamate resistenti all'acido.
Colorante secondario
Dopo lo scolorimento del campione, questo è in contrasto con un altro colorante chiamato colorante secondario. Mustileo blu o il verde malachite viene generalmente utilizzato.
La tintura secondaria macchia il materiale di fondo e, di conseguenza, crea contrasto con le strutture tinte nel primo passo. Solo le cellule scolorite assorbono il secondo colorante (controccia) e prendono il loro colore, mentre le cellule resistenti agli acidi mantengono il colore rosso.
Questa procedura viene spesso utilizzata per l'identificazione di Mycobacterium tuberculosis E Mycobacterium leprae, che sono chiamati bacilli alcolici acidi resistenti.
Reagenti
Colorante primario
Viene utilizzato lo 0,3 % di carboli Fuchsin (filtrato). Questo colorante viene preparato da una miscela di alcoli: fenolo di etanolo (90 %) o metanolo (95 %) e in questa miscela 3 grammi di fucsin di base si dissolve.
Soluzione scoraggiante
In questo passaggio è possibile utilizzare soluzioni di acido alcolico al 3 % o acido solforico al 25 %.
Colorazione secondaria (Counter-Collars)
Il colorante più usato per il contrasto nei campioni è di solito allo 0,3 % di blu metilene. Tuttavia, possono anche essere usati altri, come lo 0,5 % di Malachite Green.
Può servirti: TiminaTecnica
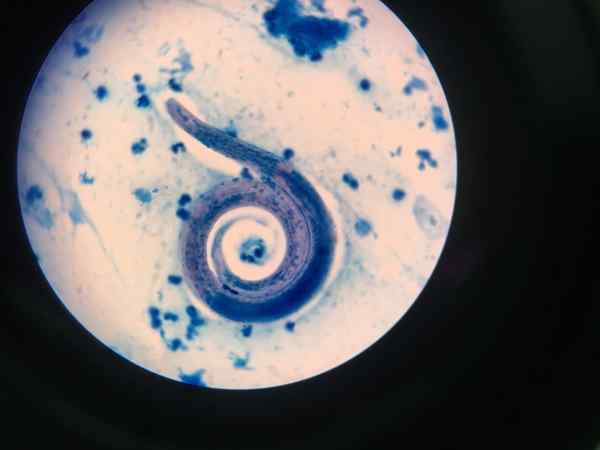 Nematode visualizzato con Ziehl-Neelsen
Nematode visualizzato con Ziehl-Neelsen Procedura di colorazione aperta con acido
Preparare uno striscio batterico
Questa preparazione viene eseguita su una diapositiva pulita e asciutta, a seguito di precauzioni di sterilità.
Essiccazione di frovis
Lascia asciugare lo striscio a temperatura ambiente.
Riscaldare il campione
Il campione deve essere riscaldato applicando il fuoco alla diapositiva sottostante. Una fissazione con alcool può essere fatta quando l'odore non si è preparato con l'imospetto (trattata con ipoclorito di sodio per sbiancarlo) e se non verrà tinto immediatamente.
M. tubercolosi viene eliminato con candeggina e durante il processo di colorazione. La termofixation dell'espettorato non trattato non ucciderà M. tubercolosi, Mentre la fissazione dell'alcool è battericida.
Coprire la macchia
La macchia è coperta dalla soluzione di carbola Fuchsin (colorazione di base primaria).
Scaldare la macchia
Questo viene fatto per 5 minuti. Dovresti notare un distacco a vapore (circa 60 ° C). È importante non surriscaldarsi ed evitare di bruciare il campione.
In relazione al riscaldamento della macchia, dovresti stare molto attento quando si riscaldano il carbola Fuchsin, specialmente se la colorazione viene eseguita su un vassoio o un altro contenitore in cui sono state raccolte sostanze chimiche altamente infiammabili dalla precedente colorazione precedente.
Solo una piccola fiamma dovrebbe essere applicata sotto le vetrini usando un'illuminazione del tampone precedentemente inumidita con alcune gocce di alcol acido, metanolo o etanolo al 70 %. Evita di usare un grande tampone imbevuto di etanolo perché questo è un rischio di incendio.
Lavare la macchia
Questo lavaggio deve essere fatto con acqua pulita. Se l'acqua del rubinetto non è pulita, lavare lo sfregamento con acqua filtrata o distillata, preferibilmente.
Copri lo striscio con alcol acido
Questo alcool acido deve essere al 3 %. La copertura viene eseguita per 5 minuti o fino a quando l'odore è sufficientemente scolorito, cioè rosa pallido.
Può servirti: epiblastoVa conto che l'alcol acido è infiammabile; Pertanto, dovrebbe essere usato con molta attenzione. Evita di essere vicino alle fonti di accensione.
Lavare la macchia
Il lavaggio dovrebbe essere con acqua pulita e distillata.
Copri lo striscio con la tintura
Può essere una colorazione verde di malachite (0,5 %) o blu di metilene (0,3 %) per 1 o 2 minuti, usando il tempo più forte se l'odore è sottile.
Lavare la macchia
L'acqua pulita (distillata) deve essere nuovamente utilizzata.
Per drenare
La parte posteriore della diapositiva deve essere pulita e la macchia è posizionata su uno scaffale di drenaggio, in modo che si asciughi nell'aria (non usi la carta assorbente per l'essiccazione).
Esamina lo striscio sul microscopio
L'obiettivo di 100x e l'olio di immersione dovrebbe essere usato. Scansiona sistematicamente lo striscio e scrivi le osservazioni pertinenti.
Interpretare i risultati
Teoricamente, i microrganismi tinti da un colore rossastro sono considerati acido alcol positivo (AAR+).
Al contrario, se i microrganismi sono tinti blu o verde, a seconda del colorante usato come contro-colletti, sono considerati acidi resistenti negativi (AAR-).
Riferimenti
- APUBA, s. & Sandhya, B. (2016). Essenziale di microbiologia pratica (1 ° ed.). Jaypee Brothers Medical Publishers.
- Bauman, r. (2014). Microbiologia con deseodas per sistema corporeo (4a ed.). Pearson Education, Inc.
- Eredità, J., Evans, e. & Killington, a. (millenovecentonovantasei). Microbiologia introduttiva (1 ° ed.). Cambridge University Press.
- Morello, j., Granato, p. Wilson, m. & Morton, V. (2006). Manuale di laboratorio e cartella di lavoro in microbiologia: applicazioni alla cura del paziente (11 ° ed.). McGraw-Hill Education.
- Vasanthakumari, r. (2007). Libro di testo di microbiologia (1 ° ed.). B.Yo. Publications Pvt.

