Wright colorazione
- 652
- 109
- Cosetta Messina
 Varie persone periferiche tinte di sangue con colorazione Wright. A. Leucemia acuta b. Plasmodium Vivax all'interno dell'eritrocita. C. Plasmodium falciparum, macrogametocito. D. Linfocita
Varie persone periferiche tinte di sangue con colorazione Wright. A. Leucemia acuta b. Plasmodium Vivax all'interno dell'eritrocita. C. Plasmodium falciparum, macrogametocito. D. Linfocita Cosa è la colorazione di Wright?
IL Wright colorazione È una tecnica di colorazione creata dal patologo americano James Homer Wright nel 1902, basato sulla colorazione di Romanowsky, per differenziare meglio diversi tipi di cellule del sangue.
Questa colorazione è policromatica, il che significa che genera diversi colori a seconda della struttura che assorbe il colorante. Questa tecnica di colorazione è stata ampiamente utilizzata per eseguire globuli bianchi differenziali e studiare la morfologia dei globuli rossi, delle piastrine e dei leucociti nel sangue periferico e nel midollo osseo.
La sua applicazione è molto importante, poiché le anomalie possono essere osservate nelle diverse linee cellulari del sangue, facilitando la diagnosi di malattie come la leucemia o le infezioni batteriche o parassita.
Forse queste sono le applicazioni più comuni in cui viene utilizzata questa tecnica, tuttavia non sono le uniche. È anche utile in altri campioni diversi dal sangue e dal midollo osseo, come campioni di secrezione nasale, muco fecale, espettorato, pelle, tra gli altri.
Fondazione della colorazione di Wright
La colorazione di Wright è nata dalla macchia Romanowsky.
La miscela di coloranti utilizzati nella colorazione Wright provoca l'effetto noto come Romanowsky, cioè fornisce una bella colorazione viola ai nuclei dei leucociti e ai granuli neutrofili, mentre i globuli rossi sono tinti di rosa.
I componenti responsabili di dare la gamma di colori tipici della colorazione di Wright sono blu B ed Eosina e. L'effetto osservato dipenderà dal collegamento dei coloranti alle strutture chimiche e dalle interazioni del blu B e dell'eosina e.
Strutture acide, come acidi nucleici, proteine nucleari e citoplasma reattivo immaturo di alcuni tipi di cellule, set blu B (colorazione di base).
Mentre le strutture di base, come l'emoglobina, i granuli degli eosinofili segmentati, tra le altre strutture cellulari, impostano l'eosina e (colorazione acida).
Il risultato della colorazione può essere influenzato da diversi fattori, come il pH del colorante Wright, la soluzione di smorzamento e lavaggio, nonché il tempo di colorazione e fissaggio.
Pertanto, ogni passo nella preparazione dei reagenti è cruciale e deve essere fatto prendersi cura di ogni dettaglio.
Materiali
Dye Wright. Per 100 ml è necessario:
Pesare 0.3 gr di colorante Wright, misura 97 ml di metanolo e 3 ml di glicerolo.
Preparazione
In un mortaio posizionano la pesante quantità di tintura di Wright e incorpora gradualmente il glicerolo fino a quando la polvere non viene completamente sciolta.
Successivamente, il metanolo viene aggiunto, miscelato e versato in una bottiglia ambra.
Prima di utilizzare, la soluzione con movimenti morbidi e filtro deve essere mescolata.
Può servirti: selezione direzionale: cosa è, definizione, esempiSoluzione tampone tamponata
In un litro di acqua distillata, vengono aggiunti 3,76 g di disodio idrofosfato (NA2HPO4 2h20) più 2,1 gr di fosfato di potassio diidrogeno (KH2Po4).
Mescola molto bene finché non si dissolve tutti i reagenti incorporati. Regola il pH a 7,2. Versare in un barattolo di vetro e mantenere a temperatura ambiente.
Materiali aggiuntivi necessari per eseguire la colorazione
Inoltre, sono necessari altri materiali per eseguire la tecnica di colorazione, questi sono: oggetti o copertine porta, ponte di colorazione, nastri con acqua o tampone per il lavaggio, un cronometro per assumere tempi di colore e un po 'di materiale di asciugatura (carta assorbente, garza o cotone ).
Componenti di colorazione Wright
Metanolo
L'alcool (metanolo) funge da fissatore dello spalmatura del sangue sulla diapositiva.
Fondamentalmente è una riduzione del fissativo reattivo, disidratatore e coagulante. Pertanto, la loro funzione è quella di coagulare le proteine e renderle insolubili, ma senza essere denaturati.
Il metanolo è il reagente più usato per riparare lo striscio in tutti i laboratori, poiché fornisce risultati migliori rispetto a quelli ottenuti con etanolo. La concentrazione ideale è del 99%.
Lo shock assorbitore
L'assorbitore di shock (soluzione tamponata) ha la funzione di regolazione o manutenzione.
Il passaggio del fissaggio con il metanolo disidrata le cellule e l'assorbitore di urti aiuta a reidratarle.
Eosina (Y)
Eosina ha un'affinità per i componenti di base perché è un colorante acido. Due tipi di eosina sono noti molto simili tra loro, tanto che entrambi possono essere usati, ottenendo lo stesso risultato.
Uno si chiama eosina e, eosina gialla o tetrabromofluoresceina e l'altro, eosina B, eritrosina bluastra o dibromoditrofluoresceina. Tuttavia, l'eosina ed è quello che viene utilizzato più frequentemente.
La proprietà più importante di questo colorante è la sua polarità negativa, questo lo rende attratto dalle strutture cellulari con carico positivo.
Blu di metilene
È la tintura di base. La sua proprietà principale è la metacromia, cioè non tutte le strutture saranno tinte dello stesso colore, dipenderà dalla composizione chimica delle strutture che stanno colorando.
Alcuni diventeranno leggeri o blu scuro e altri di viola scuro o lilla pallida.
Tecnica
- Crea il campione esteso in modo che ci sia un film sottile, sia su una diapositiva che su una copertura.
- Lascia asciugare l'aria per circa 2 ore.
- Posizionare l'odore secco sul ponte di colorazione o il secchio di colorazione con il campione esteso verso l'alto.
- Copri il foglio con la caduta di Wright di Gota per coprire l'intera superficie. Lascia l'atto per 5-8 minuti.
- Il colorante deve coprire completamente la diapositiva, senza versare attraverso i bordi. Se durante la colorazione inizia a evaporare, è necessario inserire gocce aggiuntive.
- Successivamente aggiungi una quantità uguale di ammortizzatore, soffiare un po 'fino a quando non appare la caratteristica luminosità metallica. Dundominato da 10 a 15 minuti.
- Lavare con acqua del rubinetto, posizionando il getto morbido fino a quando il foglio sembra rosa.
- Con una garza impregnata di alcol eliminato la colorazione da colorare sul retro del diapositiva.
- Lascia asciugare lo striscio prima di posizionare l'olio di immersione per visualizzarlo sul microscopio.
Usi/applicazioni della colorazione Wright
Ematologia
È ideale per la colorazione di emergenza periferica.
A causa delle proprietà chimiche di questa combinazione di coloranti, le strutture cellulari possono essere facilmente riconosciute, essendo in grado di distinguere i diversi tipi di cellule presenti.
Rinorrea
Questa tecnica è molto utile per identificare le cellule di secrezione nasale (cellule epiteliali, eosinofili segmentati, polimorfonucleare) nella diagnosi di rinite allergica.
parassitologia
In questo senso, è stato utile per lo studio di Leishmania sp All'interno degli istiociti del tessuto cellulare sottocutaneo nelle ulcere della pelle. Viene inoltre utilizzato per identificare i leucociti nel campione di feci (leucogramma fecale).
In questo caso, è interessante per il medico sapere se la leucocitosi presente nelle feci è di polimorfonucleare o mononucleare. Questa scoperta nel leucogramma fecale guiderà se si tratta di un'infezione batterica o virale, rispettivamente.
D'altra parte, i parassiti che circolano nel sangue possono essere all'interno dell'eritrocita o liberi nel plasma. I parassiti ricercati lo sono Plasmodium spp, tripanosoma cruzii e filaria, e in veterinario è utile nella ricerca Theilery equ E Babesia Caballi, Agenti causali del bambino, specialmente nei cavalli.
La colorazione di Wright, e anche quella di Giemsa, consente di differenziare gli emoparasiti dai normali componenti cellulari. Per questo, è possibile utilizzare due tipi di quelli estesi:
Fine esteso
Il sangue è esteso come un film sottile su una diapositiva. Wright Staining, rivelando le caratteristiche del nucleo e del citoplasma.
Caduta spessa
Questa metodologia viene utilizzata per studiare la presenza di parassiti in una maggiore quantità di sangue.
Per questo una grande goccia di sangue viene posizionata su una diapositiva. Una volta lì è necessario defibrina, facendo cerchi sempre più grandi dal centro, usando il bordo di un'altra diapositiva.
Infine, per osservare i parassiti nell'odore spesso, gli eritrociti devono essere elencati con acqua.
Infezioni respiratorie
A livello respiratorio, questa tecnica è anche utile, poiché le cellule presenti nei campioni di espettorato, il lavaggio bronchiale o bronchalveolare sono importanti per stabilire la diagnosi.
Qui puoi distinguere le cellule polimorfonucleate e le cellule mononucleari.
Batteriologia
L'uso di questa tecnica in batteriologia è limitato, perché non è bene tingere i batteri. Pertanto, per la loro colorazione, vengono utilizzate altre tecniche di colorazione specializzate.
Tuttavia, è stato usato per cercare cellule epiteliali con corpi di inclusione Chlamydia trachomatis In striscia di mucosa uretrale o endocervicale, sebbene si debba riconoscere che non è il metodo migliore.
Può servirti: emocianiniÈ anche possibile osservare, tra i globuli rossi, i batteri a spirale, come Borrelia Burgdorferi Nei pazienti infetti, così come a moras o corpi di inclusione di Ehrlichia sp Nel citoplasma di linfociti, monociti o neutrofili in uno striscio di sangue.
Micologia
Lui Histoplasma capsulatum È un fungo patogeno di frequente diagnosticato dall'osservazione microscopica di vari campioni di tessuto, tintura con colorazione Wright.
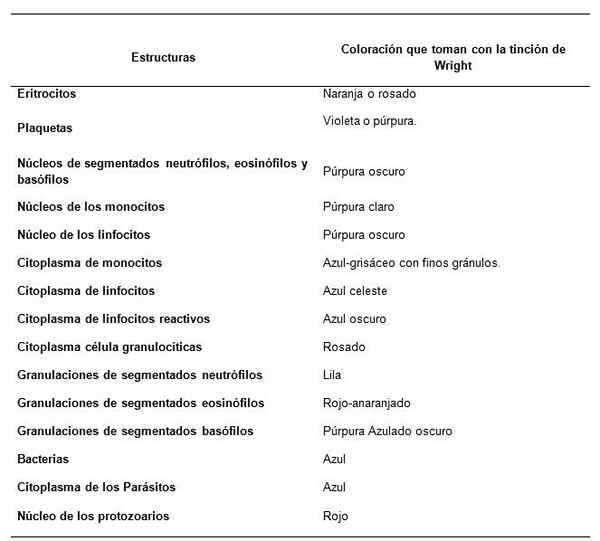
Come vengono osservate le strutture del campione di sangue con la colorazione di Wright?
 Raccomandazioni per la tinca di Srols sanguigni per la lettura dell'emogramma. Fonte: Retamales E, Mazo V. Public Health Institute, Government of Cile
Raccomandazioni per la tinca di Srols sanguigni per la lettura dell'emogramma. Fonte: Retamales E, Mazo V. Public Health Institute, Government of Cile Raccomandazioni per una buona colorazione
- Le estensioni dei campioni di sangue devono asciugare spontaneamente. Gli strisci dovrebbero essere il più sottili possibile per ottenere una migliore fissazione del colorante ed evitare di sovrapposizione.
- Per la tintura di alta qualità, è consigliabile. D'altra parte, il campione ideale è il sangue capillare, senza anticoagulante.
- Tuttavia, se viene utilizzato il sangue venoso, dovrebbe essere usato come anticoagulante EDTA e non -eparina, poiché quest'ultimo può deformare le strutture cellulari.
- Per evitare il deterioramento del colorante preparato, deve essere conservato in luoghi asciutti.
- Durante il processo di lavaggio si consiglia l'uso dell'acqua regolata a pH neutro.
- È consigliabile testare i metodi di tintura utilizzati di tanto in tanto in laboratorio.
Questo è fatto campioni di colorazione o motivi estesi, come controllo di qualità. Questo passaggio è importante, poiché si assicura che la colorazione sia adeguatamente preparata e che i tempi di colorazione sono ben standardizzati.
Se il foglio del motivo è gravemente colorato, allora ci sono problemi che devono essere risolti.
Errori comuni nella colorazione di Wright
Colorazione molto pallida
Le macchie molto pallide sono generalmente dovute a un tempo molto breve di colorazione o di un lavaggio molto esagerato. Viene corretto allungando il tempo di contatto con la tintura o diminuendo il tempo di lavaggio.
Campane della tintura
La presenza di coloranti precipitati nell'odore può avere diverse cause. I più frequenti sono: uso del colorante non filtrato, colorante su ponti di colorazione irregolare, indossare lenzuola sporca con polvere o grasso, non fare un buon lavaggio quando la colorazione è completata.
Strofinare con colorazione estremamente rossastra o blu
L'assorbitore di shock è responsabile del pH del colorante. I colori con pH al di sotto del (acido) indicato si tradurranno nell'ottenimento di odori molto rossastri.
Se il pH del colorante è superiore (alcalino) otterrà uno striscio estremamente bluastro.
Modalità di archiviazione
Il reagente deve essere conservato a temperatura ambiente.
Riferimenti
- López-jácome, l., Hernández-Durán, m., Colín-Castro, c., Ortega-Peña, s., Cerón-González, g., Franco-Cendejas, f. (2014). Colorazione di base in laboratorio di microbiologia. Ricerca sulla disabilità.
- Calderón, a., Cardona, J., Vergara, o. (2013). Frequenza Babesia Spp. In cavalli di Montería, Córdoba (Colombia). Rev. Udcaactal Disculg. scienziato.
- Retamales, e., Mazo, v. Public Health Institute of Cile. Raccomandazioni per la tinca di Srols sanguigni per la lettura dell'emogramma.

