Colorazione di spore
- 995
- 123
- Lidia Valentini
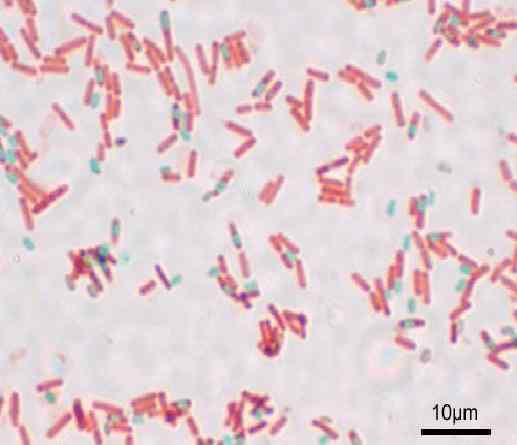
 Colorazione delle spore del metodo Shaeffer-Fulton o Wirtz-Conklin. Fonte: Y anche (uploader originale) [GFDL (http: // www.gnu.Org/copyleft/fdl.html) o cc-be-sa-3.0, Wikimedia Commons
Colorazione delle spore del metodo Shaeffer-Fulton o Wirtz-Conklin. Fonte: Y anche (uploader originale) [GFDL (http: // www.gnu.Org/copyleft/fdl.html) o cc-be-sa-3.0, Wikimedia Commons Qual è la colorazione delle spore?
IL Colorazione di spore È la metodologia utilizzata per colorare le strutture di resistenza che formano alcuni generi batterici quando sono in condizioni sfavorevoli. Serve a identificare i batteri.
Ci sono molti generi che formano le spore, tuttavia, quelle principali lo sono Bacillo E Clostridium. Questi generi sono considerati più rilevanti perché hanno specie patogene per l'essere umano.
Ogni bacillo può dare origine a una spora. Al momento della tintura della preparazione, la spora può essere trovata all'interno del bacillo (endospora) o all'esterno di questo (Exospora). Con tecniche di colorazione convenzionali per i batteri - come la colorazione di grammo - le spore sono incolori.
Al momento ci sono diverse metodologie di colorazione in grado di attraversare la spessa struttura della spora per tingerla. Queste metodologie sono molto varie e la tecnica di Dorner, la metodologia di Mgher di Möeller e Shaeffer-Fulton, nota anche come Wirtz-Conklin, possono essere menzionate.
Di tutte le tecniche menzionate, la metodologia di Shaeffer-Fulton è la più utilizzata nei laboratori di routine. Deve il suo nome a due microbiologi che hanno creato la colorazione nel 1930: Alicia Shaeffer e MacDonald Fulton. Tuttavia, a volte la tecnica si chiama Wirtz-Conklin in onore di due batteriologi del 1900.
Base
Le spore non sono tinte di colorazioni convenzionali perché hanno una parete molto spessa. La composizione complessa delle spore impedisce l'ingresso della maggior parte dei coloranti.
Se la spora dell'esterno è studiata verso l'interno, si osservano i seguenti strati: in primo luogo, c'è l'esosporium, che è lo strato più raffinato ed esterno formato dalle glicoproteine.
Poi arriva la cuticola, che fornisce resistenza alle alte temperature, seguita dalla corteccia composta da peptidoglicano. Successivamente, c'è la base della base che protegge il protoplasto.
La spora è una struttura disidratata che contiene il 15% di calcio e acido di dipicolina. Pertanto, la maggior parte delle tecniche di colorazione delle spore si basano sull'applicazione di calore in modo che il colorante possa penetrare nella struttura spessa.
Può servirti: lattogenesi: caratteristiche e fasiUna volta che la spora è macchiata, non può eliminare il colorante. Nella tecnica di Shaeffer-Fulton, il verde della malachite entra nelle cellule vegetative e, applicando il calore, penetra nell'endospora.
Quando si lava con acqua, la tintura viene rimossa dalla cellula vegetativa. Ciò si verifica perché la tintura verde della malachite è leggermente semplice, quindi la cellula vegetativa si lega debolmente.
Invece, non puoi uscire dalla spora e infine il bacillo con safranina viene assunto. Questa fondazione è valida per il resto delle tecniche, in cui accade qualcosa di simile.
Tecniche di colorazione delle spore
Per eseguire la colorazione delle spore è necessario avere una coltura pura della tensione sospetta che si desidera studiare.
Il raccolto è sottoposto a temperature estreme per 24 ore per stimolare il microrganismo allo sporolare. Per questo, il raccolto può essere collocato in 44 ° C o in frigo (8 ° C) per 24 o 48 ore.
Se lasci troppo a lungo alle temperature di cui sopra, verranno osservati solo esospaurs, poiché tutte le endospore avranno lasciato il bacillo.
Tempo culminato, devono essere posizionate alcune gocce di soluzione fisiologica sterile su una diapositiva pulita. Quindi viene presa una piccola parte del raccolto e un'ammenda estesa.
Successivamente, è consentito asciugare, è fissato nel calore e nella tintura con alcune delle tecniche spiegate di seguito:
Tecnica Dorner
- Prepararsi in un tubo di prova Una sospensione concentrata del microrganismo spo farle in acqua distillata e aggiungere un volume uguale di fenicada fucsina di kinyoun filtrata.
- Posizionare il tubo in un bagno con acqua bollente per tra 5 e 10 minuti.
- Su una diapositiva pulita miscela una goccia della sospensione precedente con una goccia di soluzione acquosa di nigrosina al 10%, bollita e filtrata.
- Estendersi e asciugare con calore morbido.
- Esamina con 100x Target (immersione).
Le spore sono tinte in rosso e le cellule batteriche appaiono quasi incolori contro uno sfondo grigio scuro.
Può servirti: elminenza: origine, quali studi, esempio di ricercaTecnica Dorner modificata
- Uno esteso di una sospensione del microrganismo spo farle viene fatta su una diapositiva e fissata per calore.
- Il campione è coperto da una striscia di carta da filtro a cui viene aggiunta Fenicada Fuchsin. Il colorante viene riscaldato da 5 a 7 minuti con la fiamma del Bunsen più leggero fino a quando non viene generato il distacco di vapore. Quindi la carta viene ritirata.
- La preparazione con l'acqua viene lavata e quindi si asciuga con carta assorbente.
- Lo striscio è coperto da un film sottile di nigrosina al 10%, usando una seconda diapositiva per estendere la nigrosina o un ago.
La colorazione presa da spore e batteri è uguale a quella descritta nella tecnica precedente.
Tecnica Shaeffer-Fulton o Wirtz-Conklin
- Fai un'ammenda estesa con una sospensione di microrganismo spo fari su uno scivolo e fissa il calore.
- Coprire la diapositiva con una soluzione acquosa di malachite verde al 5% (è possibile posizionare una carta da filtro sul foglio).
- Riscalda la fiamma dell'accendino di Bunsen fino a quando non provoca il distacco di vapore e rimuovere la fiamma. Ripeti l'operazione da 6 a 10 minuti. Se durante la procedura evapora la soluzione verde di malachite, si può aggiungere di più.
- Rimuovere la carta da filtro (se posizionata) e lavare con acqua.
- Coprire la diapositiva con safranina acquosa allo 0,5% per 30 secondi (alcune varianti della tecnica utilizzano safranina acquosa allo 0,1% e lascialo per 3 minuti).
Con questa tecnica le spore sono presentate verdi e i bacilli rossi.
Ha l'inconveniente che le endospore di giovani colture non siano tinti bene, poiché sembrano estremamente chiari o incolori. Per evitarlo si consiglia di utilizzare colture di incubazione a 48 ore.
Tecnica Möeller
- Coprire lo striscio con cloroformio per 2 minuti.
- Scartare il cloroformio.
- Coprire con acido cromico al 5% per 5 minuti.
- Lavare con acqua distillata.
- Il foglio con carbol Fuchsin-Fenicada è coperto ed esposto alla fiamma dell'accendino Bunsen fino all'emissione di vapori, quindi viene rimosso dalla fiamma alcuni momenti. L'operazione viene ripetuta fino a 10 minuti.
- Lavare con acqua.
- Usa etanolo acidificato (alcool cloridrico) per scolorirsi. È lasciato per 20 o 30 secondi.
- Lavare con acqua distillata.
- Assumere copre il foglio con blu di metilene per 5 minuti.
- Lavare con acqua distillata.
- È permesso asciugare e portare il campione al microscopio.
Le spore sembrano rosse e il bacilli blu. È importante non aspirare ai vapori, poiché sono tossici e a lungo termine possono essere cancerogeni.
Tecnica Möeller modificata senza calore
Nel 2007, Hayama e i suoi collaboratori hanno creato una modifica della tecnica di Möeller. Hanno eliminato la colorazione del colorante e l'hanno sostituita con l'aggiunta di 2 gocce del tensioattivo Tergiditol 7 per ogni 10 ml di soluzione di carbola fennata dalla fucsina. Sono stati ottenuti gli stessi risultati.
Applicazioni
La colorazione delle spore fornisce informazioni molto preziose e utili per l'identificazione del patogeno, poiché la presenza dello stesso, la sua forma, la posizione all'interno del bacillo e la capacità di deformare la cellula vegetativa o meno, sono dati che possono guidare la specie su la specie coinvolta in un certo genere.
In questo contesto, vale la pena dire che le spore possono essere rotonde o ovali, possono essere posizionate al centro o anche in una posizione palacentrale, subterminale o terminale.
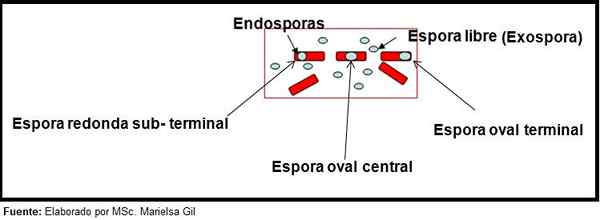 Schema della forma e della posizione delle endospore ed esosporo
Schema della forma e della posizione delle endospore ed esosporo Esempi
- Clostridium difficile Forma una spora ovale in una posizione terminale che deforma il bacillo.
- La spora di Clostridium Tertium È ovale, non deforma il bacillo e si trova a livello terminale.
- L'endospora di Clostridium Tetani È terminale e deforma il bacillo, dando l'aspetto di un tamburo.
- Le spore di Clostridium botulinum, C. Histolyticum, C. Novy E C. settico Sono rotondi o ovali, sotterranei e deformano il bacillo.
- L'endospora di Clostridium Sordelli Si trova nella posizione centrale, con una leggera deformazione.
Riferimenti
- Macchia moeller. Recuperato da.Wikipedia.org.
- Endospora. Recuperato da ES.Wikipedia.org.
- Forbes, b., Sahm, d., Weissfeld, a. Diagnosi microbiologica di Bailey e Scott. Pan -American Editoriale S.A.

