Termochimica

- 2087
- 244
- Ruth Cattaneo
Spieghiamo che è la termochimica, quali studi, le sue leggi e applicazioni
 In termochimica, le modifiche al calore sono studiate nelle reazioni chimiche
In termochimica, le modifiche al calore sono studiate nelle reazioni chimiche Cos'è la termochimica?
IL Termochimica È responsabile dello studio delle modifiche al calore che vengono eseguite nelle reazioni tra due o più specie chimiche. È considerato una parte essenziale della termodinamica, che studia la trasformazione del calore e di altri tipi di energia per comprendere la direzione in cui sono sviluppati i processi e come varia la sua energia.
È anche essenziale capire che il calore comporta il trasferimento di energia termica che si verifica tra due corpi, quando questi sono a temperature diverse; Mentre l'energia termica è associata al movimento casuale che atomi e molecole possiedono.
Pertanto, poiché quasi tutte le reazioni chimiche, l'energia viene assorbita o rilasciata attraverso il calore, l'analisi dei fenomeni che si verificano attraverso la termochimica è molto rilevante.
Quali studi termochimica?
La termochimica studia i cambiamenti di calore sotto forma di calore che si verificano nelle reazioni chimiche o quando si verificano processi che implicano trasformazioni fisiche.
In questo senso, alcuni concetti devono essere chiariti all'interno dell'argomento per una maggiore comprensione dello stesso.
Sistema
Ad esempio, il termine "sistema" si riferisce al segmento specifico dell'universo che viene studiato, essere inteso come "universo" la considerazione del sistema e dei suoi dintorni (tutto esterno a questo).
Quindi, un sistema è generalmente costituito dalla specie coinvolta nelle trasformazioni chimiche o fisiche che si verificano nelle reazioni. Questi sistemi possono essere classificati in tre tipi: aperti, chiusi e isolati:
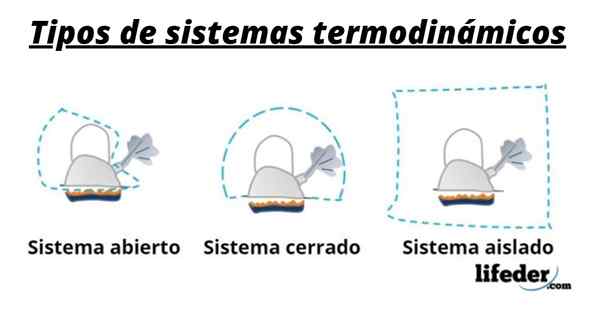
- Un sistema aperto è quello che consente il trasferimento di materia e energia (calore) con l'ambiente circostante.
- In un sistema chiuso c'è uno scambio di energia ma non della materia.
- In un sistema isolato il trasferimento di materia o energia sotto forma di calore non è presentato. Questi sistemi sono anche noti come "adiabatici".
Leggi termochimiche
 Germain Hess, creatore della legge di Hess, fondamentale per la termochimica
Germain Hess, creatore della legge di Hess, fondamentale per la termochimica Le leggi della termochimica sono strettamente legate alla legge di Laplace e Lavoisier, così come la legge di Hess, che sono i precursori della prima legge della termodinamica.
Il principio stabilito dal francese Antoine Lavoisier (importante chimico e nobile) e Pierre-Simon Laplace (famoso matematico, fisico e astronomo) recensioni che “L'alterazione dell'energia che si manifesta in qualsiasi trasformazione fisica o chimica ha lo stesso e significativo magnitudine contrariamente all'alterazione dell'energia della reazione inversa ".
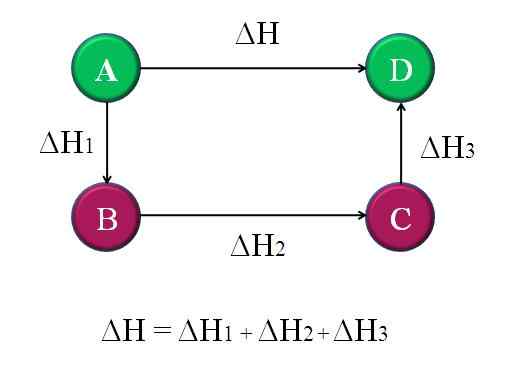
Legge di Hess
 Diagramma semplice e generale in cui viene applicata la legge di Hess per quattro reazioni chimiche
Diagramma semplice e generale in cui viene applicata la legge di Hess per quattro reazioni chimiche Nello stesso ordine di idee, la legge formulata dal chimico russo dalla Svizzera, Germain Hess, è una pietra miliare per la spiegazione della termochimica.
Questo principio si basa sulla sua interpretazione della legge sul risparmio energetico, che si riferisce al fatto che l'energia non può essere creata o distrutta, trasformata solo.
La legge di Hess può essere promulgata in questo modo: "L'entalpia totale in una reazione chimica è la stessa, se la reazione viene effettuata in un unico passaggio come se accadesse in una sequenza di diversi passaggi".
L'entalpia totale si verifica come la sottrazione tra la somma dell'entalpia dei prodotti tranne la somma dell'entalpia dei reagenti.
In caso di cambiamento nell'entalpia standard di un sistema (in condizioni standard di 25 ° C e 1 atm), può essere schematizzato secondo la seguente reazione:
Può servirti: acido clorogenicoΔHreazione = ΣΔH(prodotti) - ΣΔH(reagenti)
Un altro modo per spiegare questo principio, sapere che il cambiamento di entalpia si riferisce al cambiamento di calore nelle reazioni quando vengono dati a una pressione costante, è dire che il cambiamento nell'entalpia netta di un sistema non dipende dal percorso che segue tra lo stato iniziale e la fine.
Prima legge della termodinamica
Questa legge è così intrinsecamente legata alla termochimica che a volte è confusa quale ha ispirato l'altro; Quindi, per dare luci a questa legge, si deve iniziare dicendo che ha anche le sue radici nel principio di conservazione dell'energia.
In modo che la termodinamica non solo tenga conto del calore come forma di trasferimento di energia (come la termochimica), ma coinvolge anche altre forme di energia, come l'energia interna (O).
Quindi la variazione dell'energia interna di un sistema (ΔU) è data dalla differenza tra i suoi stati iniziali e finali (come visto nella legge di Hess).
Tenendo conto che l'energia interna è composta da energia cinetica (movimento delle particelle) e energia potenziale (interazioni tra particelle) dello stesso sistema, si può dedurre che ci sono altri fattori che contribuiscono allo studio dello stato e delle proprietà di ciascun sistema.
Applicazioni termochimiche
La termochimica ha più applicazioni, alcune di queste saranno menzionate di seguito:
- Determinazione dei cambiamenti di energia in alcune reazioni attraverso l'uso della calorimetria (misurazione dei cambiamenti di calore in alcuni sistemi isolati).
- Detrazione di cambiamenti di entalpia in un sistema, anche se non possono essere conosciuti da una misurazione diretta.
- Analisi dei trasferimenti di calore prodotti sperimentalmente quando si formano composti organometallici con metalli di transizione.
- Studio delle trasformazioni energetiche (in calore) somministrati in composti di coordinamento delle poliammine con metalli.
- Determinazione delle entalpie del legame metallo-ossigeno di β-dics e β-dics uniti ai metalli.
- Oltre alle precedenti applicazioni, la termochimica può essere utilizzata per determinare un gran numero di parametri associati ad altri tipi di funzioni energetiche o statali, che sono quelli che definiscono lo stato di un sistema in un determinato momento.
- La termochimica è anche utilizzata nello studio di numerose proprietà composte, come nella calorimetria di titolazione.
Riferimenti
- Wikipedia. (S.F.). Termochimica. Recuperato da.Wikipedia.org
- Chang, R. (2007). Chimica, nona edizione. Messico: McGraw-Hill.
- Librettexts. (S.F.). Termochimica - una revisione. Ottenuto da Chem.Librettexts.org
- Tyagi, p. (2006). Termochimica. Recuperato dai libri.Google.co.andare
- Ribeiro, m. A. (2012). Termochimica e sue applicazioni a sistemi chimici e biochimici. Ottenuto dai libri.Google.co.andare
- Singh, n. B., Das, s. S., E Singh,. K. (2009). Chimica fisica, volume 2. Recuperato dai libri.Google.co.andare

