Sistemi di teoria delle collisioni, energia, esempi
- 2899
- 296
- Cosetta Messina
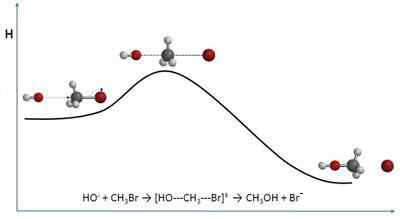
IL teoria delle collisioni Spiega le velocità delle reazioni chimiche da una prospettiva semplicemente molecolare. È quindi strettamente vicino alla cinetica chimica. Invece di avvicinarsi alle velocità in termini di concentrazioni, lo fa in base alle frequenze di collisione.
Quando si parla di collisioni, l'immagine di alcune palle da biliardo può venire in mente a colpire l'un l'altro sul tavolo. Tuttavia, le molecole, sebbene questa teoria presuppone che le sue forme siano sferiche, non si comportano in modo simile. Le collisioni molecolari differiscono in diversi modi, sia spaziali che energetici.

Questa teoria, sebbene possa essere matematicamente un po 'complessa e mostrare notevoli variazioni riguardanti i risultati sperimentali, offre un'immagine di interpretazioni visibili e senza aspetti astratti.
Sebbene sia applicato per sistemi gassosi o soluzioni molto diluite, i suoi principi possono estendersi a qualsiasi reazione e mezzo fisico.
[TOC]
Condizioni per le reazioni che si verificano
Secondo la teoria delle collisioni ci sono tre condizioni per le reazioni:
- Specie chimiche (ioni, molecole, radicali, ecc.) Devono scontrarsi in modo efficiente.
- Devono trasportare abbastanza energia per la rottura dei loro collegamenti.
- Inoltre, l'orientamento all'impatto deve essere molto specifico.
Collisioni molecolari
 Come nel bowling, le reazioni si svolgono solo quando si verificano collisioni efficienti in termini di energia e guida
Come nel bowling, le reazioni si svolgono solo quando si verificano collisioni efficienti in termini di energia e guida Le collisioni molecolari condividono qualcosa in comune con macroscopico: si verificano principalmente tra due specie o corpi. Due palle da biliardo si scontrano tra loro, oltre a una palla da calcio contro un muro, o due proiettili nel mezzo dell'aria. Cioè, le collisioni per quanto riguarda la chimica e le sue reazioni tendono ad essere di tipo bimolecolare.
Può servirti: ionizzazione in fisica e chimica: concetto, processo ed esempiLe molecole non sono ancora, ma si muovono e ruotano attraverso lo spazio che li circonda. In tal modo, si presume che disegnino una sorta di cerchio chiamato sezione trasversale, su cui esiste la probabilità che un'altra molecola di Colison. Allo stesso modo, la teoria considera che le molecole siano sferiche per semplificare i modelli matematici.
Due molecole, ipoteticamente sferiche, possono scontrarsi senza alcun problema, anche se non vi è alcuna reazione chimica. Ma non accade allo stesso modo quando si tratta di tre, quattro o più molecole.
Più specie dovrebbero scontrarsi per originare un prodotto, più è improbabile il fenomeno. Questo è spiegato visivamente provando che tre palle o proiettili si scontrano allo stesso tempo insieme. Pertanto, le collisioni bimolecolari sono di gran lunga le più comuni.
Sistemi
Solo la teoria delle collisioni è valida per i sistemi o le fasi software. Questo perché i gas mostrano un comportamento che può essere ben descritto dalla loro cinetica.
Per fasi liquide o soluzioni molto diluite, le specie reattive sono avvolte in una gabbia di molecole di solvente, con la quale si scontrano anche. Ciò modifica il panorama, poiché le reazioni non dipendono solo dalle frequenze delle collisioni, ma anche dalla diffusione delle molecole reagenti attraverso il mezzo.
Energie di collisione
Le molecole possono scontrarsi lentamente o molto rapidamente. Questo dipende da quanto grande è la sua energia, che a sua volta varia in modo significativo con la temperatura. Più forte è la collisione, la probabilità che vi sia una reazione chimica aumenterà, poiché questa energia può rompere i collegamenti necessari per formarne di nuovi.
Può servirti: monomeriQuesta energia è conosciuta come attivazione eA, Ed è caratteristico per qualsiasi reazione chimica. Quando la temperatura aumenta, la media delle molecole è in grado di abbinare o superare EA, Quindi il numero di collisioni efficaci e, quindi, i prodotti formati, aumentano.
In presenza di un catalizzatore eA diminuisce, poiché fornisce superfici e mezzi elettronici che le collisioni dei benefici. Il risultato: la velocità di reazione aumenta, senza aumentare la temperatura o aggiungere altri reagenti.
Fattore sterico
Le specie chimiche si scontrano efficacemente per reagire, prevedendo questa teoria quale sarà la velocità delle loro reazioni. Tuttavia, gli esperimenti hanno dimostrato che più complesse sono le strutture dei reagenti, maggiori sono le deviazioni o le differenze tra le velocità teoriche e sperimentali.
Questo perché le molecole sono tutt'altro che sferiche, ma spazialmente hanno tutti i tipi di geometrie. Qui è dove entra il fattore sterico, ρ, con cui cerca di correggere le velocità di reazione in modo che le previsioni della teoria con i risultati sperimentali siano migliori.
Esempi di reazioni
Reazione bimolecolare
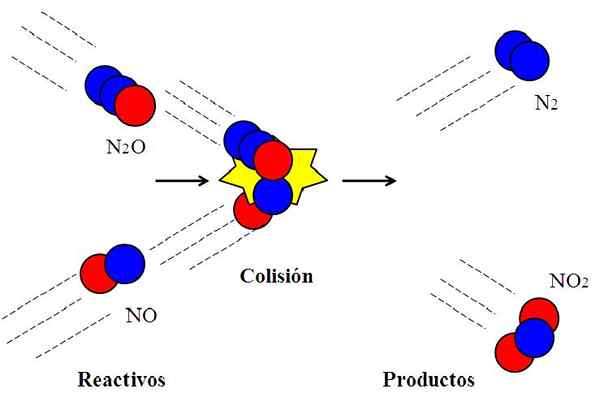 Collisione efficace tra ossidi di azoto. Fonte: Gabriel Bolívar.
Collisione efficace tra ossidi di azoto. Fonte: Gabriel Bolívar. La seguente reazione:
N2O + No → N2 + NO2
È comunemente usato per spiegare cosa significa un orientamento efficace nelle collisioni molecolari.
La molecola n2Oppure, ossido di dyitrogen, non reagirà con il no, ossido nitrico, a meno che durante la collisione l'atomo di ossigeno (cerchio rosso) della n2O shock direttamente con l'atomo di azoto (cerchio blu) del no. Solo in questo modo i prodotti n avranno origine2 e non2; Altrimenti, n molecole2O e non rimbalzano senza reagire.
Può servirti: stato gassoso: caratteristiche, diritto generale, esempiQuesto è un esempio di collisione bimolecolare per una reazione bimolecolare elementare. Anche quando i reagenti hanno abbastanza energia per rompere i collegamenti, se l'orientamento non è appropriato, non vi sarà alcuna reazione chimica.
Reazione unimolecolare
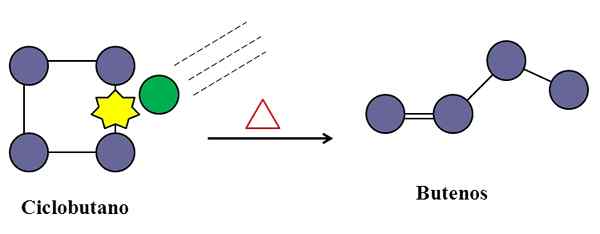 Le collisioni sono anche indispensabili per l'isomerizzazione del ciclobutano. Fonte: Gabriel Bolívar.
Le collisioni sono anche indispensabili per l'isomerizzazione del ciclobutano. Fonte: Gabriel Bolívar. In una reazione elementare unimolecolare, anche le collisioni molecolari possono intervenire, anche se è solo una specie che subisce la trasformazione o la rottura dei suoi collegamenti.
Considera ad esempio l'isomerizzazione del ciclobutano per dare origine a una miscela di butanes. Quando la temperatura aumenta, le molecole di ciclobutano vibrano a frequenze più elevate e si scontrano con una forza maggiore. I prodotti, tuttavia, mostrano che due molecole di ciclobutano non reagiscono tra loro perché altrimenti produrrebbero un composto con otto carboni.
Nel mezzo ci possono essere impurità (cerchio verde), che si scontrano anche con il ciclobutano, in particolare su uno qualsiasi dei suoi collegamenti C-C. Questi possono essere gas nobili, o non molecole molto reattive come l'azoto.
Verrà un momento in cui l'impurità si scontrerà con energia sufficiente per rompere uno dei collegamenti C-C del ciclobutano. E poi, la sua molecola cercherà di riorganizzare e avere origine un buutene, riconoscibile per il suo doppio legame e la sua struttura a catena lineare.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Glalasstone. (1970). Trattato di fisica. Aguilar s. A. di edizioni, Juan Bravo, 38, Madrid (Spagna).
- Walter J. Moore. (1962). Chimica fisica. (Quarta edizione). Longmans.
- Wikipedia. (2020). Teoria delle collisioni. Recuperato da: in.Wikipedia.org
- I redattori di Enyclopedia Britannica. (2020). Teoria delle collisioni. Britannica Enciclopedia. Recuperato da: Britannica.com
- Clark Jim. (2018). La teoria della colisione dei tassi di reazione. Recuperato da: ChemGuide.co.UK
- Lawson p. & Inferiore s. (18 maggio 2020). La teoria della colisioni. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- « Caratteristiche del testo didattico, struttura, tipi ed esempi
- Paesi e caratteristiche insulari dell'America o delle Antille »

