Tabella periodica degli elementi
- 4020
- 895
- Kayla Serr
Qual è la tabella periodica degli elementi?
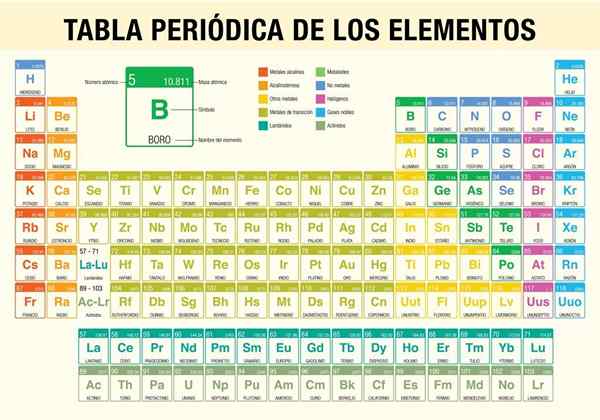
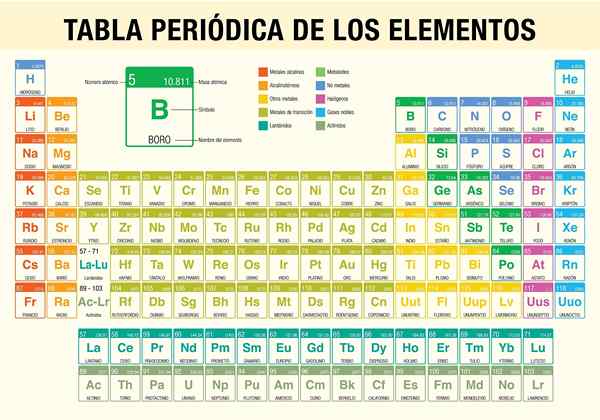
IL Tabella periodica degli elementi È uno strumento che ti consente di consultare le proprietà chimiche degli 118 elementi noti finora. È indispensabile quando si eseguono calcoli stechiometrici, prevedendo le proprietà fisiche di un elemento, classificandole e trovano proprietà periodiche tra tutte.
Gli atomi diventano più pesanti poiché i loro nuclei aggiungono protoni e neutroni, che devono anche essere accompagnati da nuovi elettroni; Altrimenti, l'elettroneutralità non sarebbe possibile. Pertanto, alcuni atomi sono molto leggeri, come l'idrogeno e altri, superpesados, come Oganerson.
Fu lo scienziato Dmitri Mendeléyev, che nel 1869 (quasi 150 anni fa) pubblicò, dopo un decennio di studi e esperimenti teorici, la prima tavola periodica nel tentativo di organizzare i 62 elementi noti in quel momento.
Qual è la tabella periodica?
Gli usi principali della tabella sono:
- Conoscere il simbolo e il nome di ogni elemento chimico che esiste.
- Conoscere la massa atomica e il numero atomico dell'elemento.
- Informare le relazioni tra i diversi elementi.
- Mostra le diverse tendenze (periodicità).
- Classificazione di tipi di elementi chimici. Questi tipi includono metalli alcalini, metalli di base, metalli di transizione, non metalli, gas nobili, alogeni, terre alcaline, semimetri, actinidi e lantanidi.
- Prevedere le proprietà di nuovi elementi non ancora scoperti o non sintetizzati.
Come è organizzata la tabella periodica? (Struttura e organizzazione)
Periodi
Gli elementi sono ordinati in file o periodi a seconda del livello di energia dei suoi orbitali. Prima del periodo 4, quando gli elementi seguirono in aumento crescente della massa atomica, fu che per ogni otto le proprietà chimiche furono ripetute di nuovo (legge delle ottave, da John Newlands).
I metalli di transizione sono intrufolati in altri elementi non metallici, come lo zolfo e il fosforo. Per questo motivo, l'ingresso di fisica quantistica e configurazioni elettroniche per la comprensione delle moderne tabelle periodiche era vitale.
Gli orbitali di uno strato di energia sono riempiti con elettroni (e i nuclei di protoni e neutroni), mentre si muove per un periodo. Questo strato di energia va di pari passo con dimensioni o radio atomiche; Pertanto, gli elementi dei periodi più alti sono più piccoli di quelli che si trovano di seguito.
L'H e l'ho trovato nel primo livello di energia (periodo); la prima riga di scatole grigie, nel quarto periodo; e la fila delle scatole di Ananjadas, nel sesto periodo. Si noti che, sebbene quest'ultimo sembra essere nel presunto nono periodo, in realtà appartiene al sesto, subito dopo la scatola gialla di BA.
Gruppi
Touring a periodo è che la massa, il numero di protoni ed elettroni aumentano. Nella stessa colonna o gruppo, sebbene la massa e i protoni variano, il numero di Elettroni a strato di Valencia è la stessa.
Ad esempio, nella prima colonna o gruppo, l'H ha un solo elettrone nell'orbitale 1S1, Come il li (2s1), Il sodio (3s1), Potassio (4s1) E così via al Francia (7s1). Quel numero 1 indica che questi elementi hanno a malapena un elettrone di Valencia, e quindi appartengono al gruppo 1 (AI). Ogni elemento è in periodi diversi.
Senza contare idrogeno, scatola verde, gli elementi sotto di esso provengono da scatole arancioni e sono chiamati metalli alcalini. Un altro nella casella destra in qualsiasi periodo, è il gruppo o la colonna 2; Cioè, i suoi elementi hanno due elettroni di valenza.
Può servirti: prestazioni teoricheMa quando ti muovi a destra, senza la conoscenza degli orbitali D, raggiungi il gruppo Boro (B) o Gruppo 13 (IIIA); Invece del gruppo 3 (iiib) o scandio (SC). Prendendo in considerazione il riempimento degli orbitali d, i periodi delle scatole grigie iniziano a essere percorsi: i metalli di transizione.
Numeri protoni vs elettroni di Valencia
Quando si studia la tavola periodica, può sorgere confusione tra il numero atomico Z o il numero di protoni totali nel nucleo e la quantità di elettroni di valenza. Ad esempio, il carbonio ha uno z = 6, cioè ha sei protoni e quindi sei elettroni (altrimenti non potrebbe essere un atomo con carico neutro).
Ma di quei sei elettroni, Quattro sono di Valencia. Per questo motivo la sua configurazione elettronica è [lui] 2s22 p2. [Egli] indica i due elettroni 1S2 dello strato chiuso e teoricamente non partecipa alla formazione di collegamenti chimici.
Inoltre, poiché il carbonio ha quattro elettroni di valenza, "convenientemente" si trova nel gruppo 14 (IVA) della tabella periodica.
Gli elementi sotto il carbonio (sì, GE, SN, PB e FL) hanno numeri atomici (e atomici) più più elevati; Ma tutti hanno in comune i quattro elettroni di Valencia. Questa è la chiave per la comprensione del perché un elemento appartiene a un gruppo e non a un altro.
Elementi della tavola periodica
Blocco s
Come spiegato, i gruppi 1 e 2 sono caratterizzati da uno o due elettroni in orbitali s. Questi orbitali sono geometria sferica e, man mano che uno di questi gruppi discese, gli elementi stanno acquisendo strati che aumentano le dimensioni dei loro atomi.
Per presentare forti tendenze nelle loro proprietà chimiche e modi di reagire, questi elementi sono organizzati come blocchi. Pertanto, i metalli alcalini e i metalli alcalinery appartengono a questo blocco. La configurazione elettronica degli elementi di questo blocco è NS (1S, 2S, ecc.).
Sebbene l'elemento elio sia all'estremità destra della tabella, la sua configurazione elettronica è 1s2 E quindi appartiene a questo blocco.
Blocco p
A differenza dei blocchi s, gli elementi di questo blocco presentano orbitali completamente completi, mentre i loro orbitali continuano a riempire con elettroni. Le configurazioni elettroniche degli elementi appartenenti a questo blocco sono del tipo NS2Np1-6 (Gli orbitali P possono avere uno o fino a sei elettroni da riempire).
Quindi in quale parte della tabella periodica è questo blocco? A destra: le scatole verdi, abitative e blu; Cioè, elementi non metallici e metalli pesanti, come bismuto (BI) e piombo (PB).
A partire dal boro, con la configurazione elettronica NS2Np1, Il carbonio a destra aggiunge un altro elettrone: 2s22 p2. Quindi, le configurazioni elettroniche degli altri elementi del periodo 2 del blocco P sono: 2s22 p3 (azoto), 2s22 p4 (ossigeno), 2s22 p5 (fluoruro) e 2s22 p6 (neon).
Se i periodi più bassi vengono ridotti, il livello di energia 3: 3s avrà23p1-6, E così via fino alla fine del blocco P.
Si noti che la cosa più importante in questo blocco è che, dal periodo 4, i suoi elementi hanno riempito gli orbitali (scatole blu in avanti a destra). In sintesi: il blocco S è a sinistra della tabella periodica e il blocco P, a destra.
Elementi rappresentativi
Quali sono gli elementi rappresentativi? Sono quelli che da un lato perdono facilmente gli elettroni o dall'altro, li vincono per completare l'ottetto di Valencia. In altre parole: sono gli elementi dei blocchi S e P.
Può servirti: emulsionante: processo di emulsione, aspetti molecolari, applicazioniI loro gruppi si distinguono dagli altri per mezzo di una lettera a alla fine. Quindi, c'erano otto gruppi: dall'IA a VIIIA. Ma attualmente, il sistema di numerazione utilizzato nelle moderne tabelle periodiche è l'arabo, da 1 a 18, compresi i metalli di transizione.
Per questo motivo il gruppo Boro può essere l'IIIA, o 13 (3+10); il gruppo di carbonio, IVA o 14; e quello dei gas nobili, l'ultimo a destra del tavolo, viiia o 18.
Metalli di transizione
I metalli di transizione sono tutti gli elementi delle scatole grigie. Durante i loro periodi, i loro orbitali sono riempiti, che sono cinque e possono quindi avere dieci elettroni. Poiché dieci elettroni dovrebbero compilare orbitali, allora ci devono essere dieci gruppi o colonne.
Ognuno di questi gruppi nel vecchio sistema di numerazione è stato designato con numero romano e una lettera B alla fine. Il primo gruppo, quello dello scandio, era il IIIB (3), il ferro, il cobalto e il nichel VIIIb per avere reattività molto simili (8, 9 e 10) e quella di Zinc IIB (12).
Come si può vedere, è molto più facile riconoscere i gruppi con i numeri arabi rispetto all'uso di numeri romani.
Metalli di transizione interna
Dal periodo 6 della tabella periodica, gli orbitali F iniziano ad essere energicamente disponibili. Questi devono essere riempiti prima degli orbitali d; E quindi, i suoi elementi sono generalmente messi a pezzi in modo da non estendere troppo il tavolo.
Gli ultimi due periodi, arancione e grigiastro. Ci sono sette orbitali F, che necessitano di quattordici elettroni da riempire, e quindi ci devono essere quattordici gruppi.
Se questi gruppi vengono aggiunti alla tabella periodica, ci saranno 32 in totale (18 + 14) e avranno una versione "allungata":
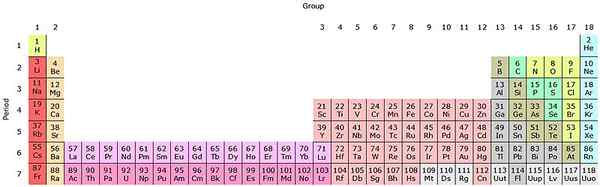 Fonte: di Sandbh [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)], da Wikimedia Commons
Fonte: di Sandbh [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)], da Wikimedia Commons La riga rosa trasparente corrisponde ai Lantanoides, mentre la riga rosa scura gli actinoidi. Il Lantano, il con z = 57, l'Actinio, AC con z = 89 e l'intero blocco F appartiene allo stesso gruppo dello scandio. Perché? Perché lo scandio ha un orbitale ND1, che è presente nel resto dei Lantanoides e degli actinoidi.
Le e AC hanno le impostazioni di Valencia 5D16s2 e 6d17s2. Mentre ti muovi direttamente su entrambe le righe, gli orbitali 4F e 5F iniziano a riempire. Una volta pieno, raggiungi gli elementi Lutocia, Lu e Laurencio, LR.
Metalli e non metalli
Lasciando dietro la torta del tavolo periodico, è più conveniente ricorrere a quella dell'immagine superiore, anche nella sua forma allungata. Al momento la stragrande maggioranza degli elementi di cui sopra sono stati metalli.
A temperatura ambiente, tutti i metalli sono sostanze solide (tranne il mercurio, che è liquido) di grigio argento (ad eccezione di rame e oro). Di solito sono anche duri e brillanti; Sebbene quelli dei blocchi s siano morbidi e fragili. Questi elementi sono caratterizzati dalla loro facilità di perdere elettroni e di formare cationi m+.
Nel caso dei Lantanoidi, i tre elettroni perdono 5D16s2 Per diventare cationi trivalenti m3+ (come lei3+). La collina, nel frattempo, è in grado di perdere quattro elettroni (CE4+).
D'altra parte, gli elementi non metallici costituiscono la parte meno della tavola periodica. Sono gas o solidi con atomi collegati covalentemente (come zolfo e fosforo). Tutti si trovano nel blocco P; Più precisamente, nella parte superiore di esso, mentre scendere ai periodi più bassi aumenta il carattere metallico (BI, PB, PO).
Inoltre, i non metallici invece di perdere elettroni, li vince. Quindi, formano anioni x- Con diversi carichi negativi: -1 per alogeni (gruppo 17) e -2 per calcoli (gruppo 16, ossigeno).
Può servirti: alcol etilico: struttura, proprietà, usi, ottenimentoFamiglie di metallo
All'interno dei metalli c'è una classificazione interna per differenziarli da:
- I metalli del gruppo 1 sono alcalini.
- Gruppo 2, Alkalinerrior Metals (SR. Scholambara).
- Gruppo 3 (IIB) Famiglia Scandio. Questa famiglia è composta dallo scandio, dalla testa di gruppo, dall'ititrium e, del Lantano, Actinio e tutti i Lantanoides e Actinoides.
- Gruppo 4 (IVB), Famiglia Titanio: TI, ZR (Cironium), HF (Hafnio) e RF (Rutherfordio). Quanti elettroni Valencia hanno? La risposta è nel tuo gruppo.
- Gruppo 5 (VB), famiglia Vanadio. Gruppo 6 (VIB), famiglia Chrome. E così via per la famiglia di zinco, gruppo 12 (IIB).
Metalloidi
Il carattere metallico aumenta da destra a sinistra e dall'alto verso il basso. Ma qual è il confine tra questi due tipi di elementi chimici? Questo bordo è costituito da elementi noti come metalloidi, che hanno caratteristiche di metalli e non metalli.
I metalloidi possono essere visti nella tavola periodica nella "scala" che inizia con il boro e termina nell'elemento radioattivo Astato. Questi elementi sono:
- B: Boro.
- SILICON: Sì.
- GE: Germanio.
- AS: Arsenic.
- SB: antimonio.
- TE: Telurio.
- AT: Astato.
Ognuno di questi sette elementi presenta proprietà intermedie, che variano in base all'ambiente chimico o alla temperatura. Una di queste proprietà è la semiconducuzione, cioè i metalloidi sono semiconduttori.
Gas
In condizioni terrestri, gli elementi gassosi ci sono quei metalli non illuminati, come azoto, ossigeno e fluoro. Inoltre, i gas di cloro, idrogeno e nobili entrano in questa classificazione. Di tutti loro, i più emblematici sono i gas nobili, per la loro bassa tendenza a reagire e comportarsi come atomi liberi.
Quest'ultimo si trova nel gruppo 18 della tavola periodica e sono:
- Helio, lui.
- Neon, ne.
- Argon, ar.
- Kripton, KR.
- Xenón, xe.
- Radón, Rn.
- E il più recente di tutti, il nobile gas oganese sintetico, OG.
Tutti i gas nobili hanno in comune la configurazione di Valencia2Np6; Cioè, hanno completato l'ottetto di Valencia.
Aggregazione Stati ad altre temperature
Gli elementi sono in stato solido, liquido o gassoso a seconda della temperatura e della resistenza delle loro interazioni. Se la temperatura terrestre si raffredda fino a quando lo zero assoluto (0K) è in giro, allora tutti gli elementi si congelerebbero; Tranne l'elio, che si condenserebbe.
A questa temperatura estrema, il resto dei gas sarebbe sotto forma di ghiaccio.
All'altro estremo, se la temperatura fosse di circa 6000k, "tutti" gli elementi sarebbero in uno stato gassoso. In queste condizioni, nuvole di oro, argento, piombo e altri metalli potevano letteralmente osservare.
Importanza della tavola periodica
Attualmente, la tavola periodica è lo strumento organizzativo più importante della chimica a causa delle relazioni dettagliate dei suoi elementi. Il suo uso è essenziale sia per studenti che per gli insegnanti e per i ricercatori e molti professionisti dedicati alla filiale della chimica e dell'ingegneria.
Con solo guardando la tavola periodica, una quantità immensa e informazioni si ottengono in modo rapido ed efficace, come ad esempio:
- Litio (li), berillio (be) e boro (b) conducono elettricità.
- Il litio è un metallo alcalino, il berillio è un metallo alcalino e il boro non è metallo.
- Il litio è il miglior pilota dei tre nominati, seguito da Beryllium e, infine, dal boro (semiconduttore).
Pertanto, individuando questi elementi nella tavola periodica, la sua tendenza alla conducibilità elettrica può essere immediatamente conclusa.