Fornire diverse caratteristiche, struttura, funzioni
- 2134
- 184
- Ruth Cattaneo
IL Dismutas superossido (Zolla erbosa) O superossido ossidretato, Costituiscono una famiglia di enzimi onnipresenti in natura, la cui funzione principale consiste nella difesa degli organismi aerobici contro i radicali senza ossigeno, in particolare i radicali anionici superossido.
La reazione che questi enzimi catalizzano si verificano virtualmente in tutte le cellule in grado di respirare (aerobica) ed è essenziale per la loro sopravvivenza, poiché elimina i radicali tossici liberi dall'ossigeno, sia negli eucarioti che nei procarioti.
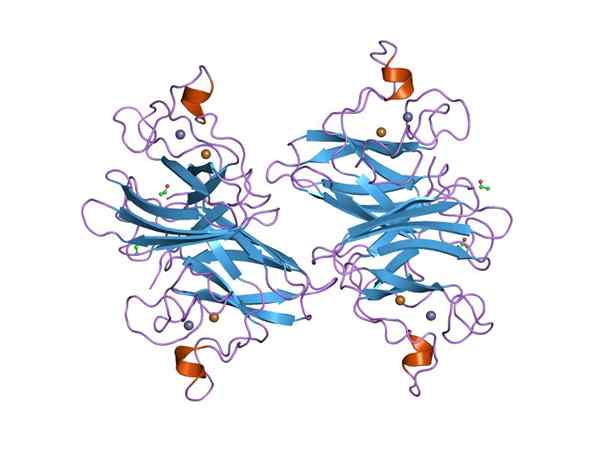
 Rappresentazione grafica di un superossido di dymputasi (SOD) Cu-Zn (fonte: Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [Dominio pubblico] tramite Wikimedia Commons) tramite Wikimedia Commons)
Rappresentazione grafica di un superossido di dymputasi (SOD) Cu-Zn (fonte: Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [Dominio pubblico] tramite Wikimedia Commons) tramite Wikimedia Commons) Molte malattie negli animali sono correlate all'accumulo di diverse specie reattive dell'ossigeno e lo stesso vale per le piante, dato che l'ambiente impone numerosi e costanti tipi di stress ossidativo che sono superati grazie all'attività di smontaggio superossido.
Questo gruppo di enzimi è stato scoperto nel 1969 da McCord e Fridovich e da allora sono stati fatti notevoli progressi riguardo a questi enzimi e alle reazioni che catalizzano negli esseri viventi.
[TOC]
Caratteristiche
Il superossido di dismutas reagisce con i radicali di superxide a tassi veramente alti, che si traduce in una linea di difesa molto efficace per la rimozione di queste molecole.
Nei mammiferi, almeno tre isoforme sono state descritte per la dismutasi di overroxido noto rispettivamente come SOD1, SOD2 e SOD3.
Due di queste isoforme hanno atomi di rame e zinco nei loro centri catalitici e differiscono l'uno dall'altro in termini di posizione: intracellulare (citosolico, SOD1 o Cu/Zn-SOD) o con elementi extracellulari (EC-SOD o SOD3).
L'isoforma SOD2 o Mn-SOD, a differenza dei due precedenti, ha un atomo di manganese come cofattore e la sua posizione sembra limitata ai mitocondri delle cellule aerobiche.
Gli isoenzimi SOD1 sono principalmente in citosol, sebbene siano stati rilevati anche nel compartimento nucleare e nei lisosomi. SOD 3 isoenzimi, al contrario, sono stati descritti nel plasma sanguigno degli umani, nei fluidi linfatici e cerebrali.
Può servirti: come cambiano gli esseri viventi nel tempo?Ognuna di queste isoforme è codificata da geni diversi, ma appartenente alla stessa famiglia e la sua regolazione trascrizionale è essenzialmente controllata da condizioni extra-intracellulari, che innescano diverse cascate di segnalazione interna.
Altro superossido dismante
Il superossido dismonico con siti catalitici che hanno ioni rame e zinco o manganese non sono unici per i mammiferi, questi sono presenti anche in altri organismi che includono piante e batteri di classi diverse.
Esiste un ulteriore gruppo di dismutas superossido, che non si trova nei mammiferi e che sono facilmente riconoscibili, poiché nel loro luogo attivo hanno ferro anziché uno dei tre ioni precedentemente descritti per le altre classi di dismatose superossido.
In E. coli, Il dismi di sovraossimento in cui contiene ferro è un enzima perplastico responsabile anche del rilevamento e dell'eliminazione dei radicali senza ossigeno generati durante la respirazione. Questo enzima è simile a quello che si trova nei mitocondri di molti eucarioti.
Le piante hanno i tre tipi di enzimi: quelli che contengono rame e zinco (Cu/Zn-SOD), che contengono manganese (Mn-SOD) e quelli contenenti ferro (Fe-SOD) nel loro centro attivo e in questi organismi funzioni analoghe a quelle degli enzimi non vegetali.
Reazione
I substrati enzimatici di Dysmy-Superossido sono anioni di superossido, che sono rappresentati come O2 e che sono composti intermedi nel processo di riduzione dell'ossigeno.
La reazione che catalizzano può essere contemplata in linee generali come la trasformazione (disputa) dei radicali liberi per la formazione di ossigeno molecolare e perossido di idrogeno, che vengono rilasciati all'ambiente o ai dipendenti come substrato da altri enzimi, rispettivamente.
Può servirti: glucani: struttura, caratteristiche e funzioniIl perossido di idrogeno può essere successivamente eliminato dalle cellule grazie all'azione di uno qualsiasi degli enzimi ma perossidasi e catalasi glutatione, che esercitano anche importanti funzioni nella protezione cellulare.
Struttura
Gli isoenzimi di superossido di dismutas nell'uomo possono differire l'uno dall'altro in termini di alcuni aspetti strutturali. Ad esempio, l'isoenzima SOD1 è di peso molecolare di 32 kDa, mentre SOD2 e SOD3 sono omotetrici di peso molecolare 95 e 135 kDa, rispettivamente.
L'altro gruppo di superossido dismatoso, il Fe-SOD presente nelle piante e in altri organismi diversi dai mammiferi, sono gli enzimi dimérrica di subunità identiche, cioè sono omodimeri.
In alcune piante, questi Fe-SOD contengono una sequenza putativa del segnale N-terminale per il trasporto all'interno dei cloroplasti e altri contengono una sequenza C-terminale di trasporto tricher ai perossisomi, quindi si presume che la sua distribuzione subcellulare sia limitata a compartimenti.
La struttura molecolare dei tre tipi di enzimi di sovraeside è consultata, in sostanza, da eliche alfa e fogli di B-Talled.
Funzioni
Il superossido dismonico difende cellule, organi e tessuti corporei di danni che i radicali senza ossigeno possono causare come la perossidazione lipidica, la denaturazione delle proteine e la mutagenesi del DNA.
Negli animali, queste specie reattive possono anche causare lesioni cardiache, accelerare l'invecchiamento e partecipare allo sviluppo di malattie infiammatorie.
Le piante richiedono anche l'attività enzimatica essenziale della dismutasi di sovraossido, poiché molte condizioni stressanti dell'ambiente aumentano lo stress ossidativo, cioè la concentrazione di specie reattive deleterose.
Negli esseri umani e altri mammiferi, le tre isoforme descritte per la dismutasi di overroxide hanno funzioni diverse. L'isoenzima SOD2, ad esempio, partecipa alla differenziazione cellulare e alla tumorogenesi e anche alla protezione contro la tossicità polmonare indotta dall'iperossia (alta concentrazione di ossigeno).
Può servirti: inulina: struttura, proprietà, cibo, controindicazioniPer alcune specie di batteri patogeni, gli enzimi SOD funzionano come "fattori di virulenza" che consentono loro di superare molte barriere di stress ossidativo a cui possono affrontare durante il processo di invasione.
Malattie correlate
Una diminuzione dell'attività della dismutasi superossido può essere data da diversi fattori, sia interni che esterni. Alcuni sono correlati a difetti genetici diretti nei geni codificanti per gli enzimi SOD, mentre altri possono essere indiretti, correlati all'espressione delle molecole regolatori.
Un gran numero di condizioni patologiche degli esseri umani è correlato agli enzimi SOD, tra cui obesità, diabete, cancro e altro.
Per quanto riguarda il cancro, è stato determinato che esiste un gran numero di tipi di tumori del cancro che hanno bassi livelli di uno dei tre superossido di mammiferi (SOD1, SOD2 e SOD3).
Lo stress ossidativo che previene l'attività di superossido dismutasi è associata anche ad altre patologie articolari come l'artrosi, l'artrite reumatoide. Molte di queste malattie hanno a che fare con l'espressione di fattori che inibiscono l'attività SOD, come il fattore TNF-α.
Riferimenti
- Fridovich, i. (1973). Swiden Dysmuta. Annu. Rev. Biochimico., 44, 147-159.
- Johnson, f., & Giulivi, C. (2005). Dismuti di superossido e l'impatto dell'IM sulla salute umana. Aspetti della medicina molecolare, 26, 340-352.
- Oberley, l. W., & Bueftner, G. R. (1979). Ruolo della distine di superossido nel cancro: una revisione. Ricerca sul cancro, 39, 1141-1149.
- Taylor, p., Bowler, c., Campo, w. Van, Montagu, M. Van, Inzé, D., E arrosto, K. (2012). Superossido smusso nelle piante. Recensioni critiche nelle scienze delle piante, 13(3), 37-41.
- Zelko, i., Mariani, t., & Folz, r. (2002). Famiglia multigene di superossido Distam: in confronto alle strutture geniche, evoluzione e espressione di SOD (SOD1), Mn-SOD (SOD2) e SOD (SOD3), evoluzione ed espressione), evoluzione e espressione SOD3) e espressione. Biologia e medicina radicali liberi, 33(3), 337-349.
- « Caratteristiche degli oligosaccaridi, composizione, funzioni, tipi
- José Rubén Romero Biografia, stile, opere »

