Struttura di solfuro di alluminio (AL2S3), proprietà, usi
- 3775
- 1102
- Dante Morelli
Lui Solfuro di alluminio (Al2S3) È un composto chimico grigio chiaro formato dall'ossidazione dell'alluminio metallico quando si perde gli elettroni dell'ultimo livello di energia e diventa un catione e dalla riduzione dello zolfo non metallico, guadagnando elettroni trasferiti dall'alluminio e diventando un anione.
Perché ciò accada e l'alluminio può produrre i suoi elettroni, è necessario presentare tre orbitali ibridi SP3, che danno la possibilità di formare collegamenti agli elettroni dallo zolfo.
La sensibilità al solfuro di alluminio d'acqua implica che, in presenza di vapore acqueo che si trova nell'aria, può reagire producendo idrossido di alluminio (AL (OH)3), idrogeno solforato (H2S) e idrogeno (H2) gassoso; Se quest'ultimo si accumula può causare un'esplosione. Pertanto, l'imballaggio solfuro di alluminio dovrebbe essere eseguito usando contenitori ermetici.
D'altra parte, poiché il solfuro di alluminio ha reattività con l'acqua, questo lo rende un elemento che non ha solvente solvente.
Struttura chimica
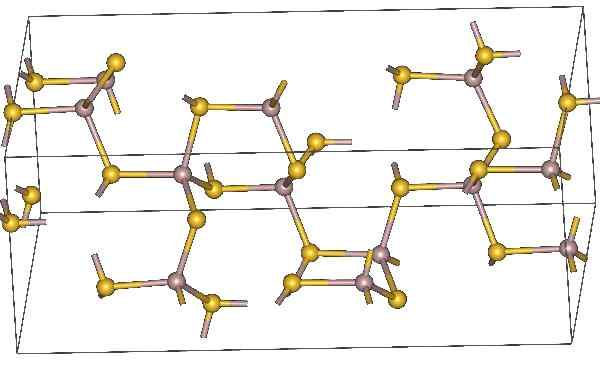
 Struttura chimica del solfuro di alluminio. Gli atomi gialli rappresentano lo zolfo. Fonte: MaterialScientist, CC BY-SA 3.0, via Wikimedia Commons
Struttura chimica del solfuro di alluminio. Gli atomi gialli rappresentano lo zolfo. Fonte: MaterialScientist, CC BY-SA 3.0, via Wikimedia Commons Formula molecolare
Al2S3
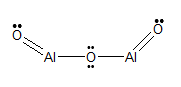
Formula strutturale
 Nomenclatura
Nomenclatura
- Solfuro di alluminio.
- Trisulfuro di alluminio DI.
- Solfuro di alluminio (III).
- Solfuro di alluminio.
Proprietà solfuro di alluminio
 Aspetto solfuro di alluminio
Aspetto solfuro di alluminio I composti chimici presentano principalmente due tipi di proprietà: fisico e chimico.
Proprietà fisiche
Massa molare
150.158 g/mol
Densità
2,02 g/ml
Punto di fusione
1100 ° C
Solubilità dell'acqua
Insolubile
Proprietà chimiche
Una delle principali reazioni del solfuro di alluminio è con l'acqua, come il substrato o il reattivo principale:

In questa reazione, si può osservare la formazione di idrossido di alluminio e quella dell'idrogeno solforato se si trova sotto forma di gas o acido solfuro se viene sciolto nell'acqua sotto forma di una soluzione. La sua presenza è identificata dall'odore delle uova marce.
Può servirti: soluzioni chimicheUsi e applicazioni
In super card pisors
Il solfuro di alluminio viene utilizzato nella fabbricazione di nano reti che migliorano la superficie specifica e la conducibilità elettrica, in modo che si possano ottenere un'elevata capacità e densità di energia la cui applicabilità è quella delle supercaugate.
Ossido di grafene (GO) - Il grafene è una delle forme alotropiche di carbonio - è servita da supporto di solfuro di alluminio (AL2S3) Con una morfologia gerarchica simile a quella di nanorambután prodotta usando il metodo idrotermico.
Azione di ossido di grafene
Le caratteristiche dell'ossido di grafene come supporto, nonché elevata conducibilità elettrica e superficie, rendono il nanorambutano2S3 Sii elettrochimicamente attivo.
Le curve di capacità CV specifiche con picchi redox ben definiti confermano il comportamento pseudocapacitivo del nanorambutano2S3 gerarchico, sostenuto nell'ossido di grafene nell'elettrolita NaOH 1M. I valori specifici della capacità CV ottenuti dalle curve sono: 168,97 alla velocità di esplorazione 5MV/s.
Inoltre, è stato osservato un buon tempo di scarica galvanostatico di 903 µs, una grande capacità specifica di 2178,16 alla corrente di 3 mA/cm di corrente2. La densità di energia calcolata dalla scarica galvanostatica è 108,91 WH/kg, alla densità di corrente di 3 mA/cm2.
L'impedenza elettrochimica conferma quindi la natura pseudocapacitiva dell'elettrodo gerarchico di nanorambutane al2S3. Il test di stabilità dell'elettrodo mostra una conservazione del 57,84 % della capacità specifica fino a 1000 cicli.
I risultati sperimentali suggeriscono che nanorambutane2S3 gerarchico è adatto per le applicazioni di supercaiding.
Può servirti: idrossido di cromo: struttura, proprietà, sintesi, usiNelle batterie al litio secondarie
Con l'intenzione di sviluppare una batteria al litio secondaria con alta densità di energia, è stato studiato il solfuro di alluminio (AL2S3) come materiale attivo.
La misura della capacità di download iniziale2S3 Era circa 1170 mAh G-1 a 100 m G-1. Ciò corrisponde al 62 % della capacità teorica di solfuro.
Al2S3 Ha mostrato una conservazione a scarsa capacità nell'intervallo potenziale tra 0,01 V e 2,0 V, principalmente a causa dell'irreversibilità strutturale del processo di carico o dell'estrazione di Li.
L'analisi XRD e K-XES per alluminio e zolfo ha indicato che la superficie di Al2S3 reagisce reversibilmente durante i processi di caricamento e scarico, mentre il nucleo di AL2S3 Ha mostrato irreversibilità strutturale, perché Lial e Li2S sono stati formati da Al2S3 Nel download iniziale e poi sono rimasti come erano.
Rischi
- A contatto con i rilasci di acqua infiammabili che possono bruciare spontaneamente.
- Causare irritazione alla pelle.
- Causare una grave irritazione oculare.
- Può causare irritazione respiratoria.
Le informazioni possono variare tra le notifiche a seconda di impurità, additivi e altri fattori.
Procedura di pronto soccorso
Trattamento generale
Cerca cure mediche se i sintomi persistono.
Trattamento speciale
Nessuno
Sintomi importanti
Nessuno
Inalazione
Porta fuori la vittima. Fornire ossigeno se la respirazione è difficile.
Ingestione
Gestisci uno o due bicchieri d'acqua e induci il vomito. Non indurre mai vomito o dare nulla in bocca a una persona inconscia.
Pelliccia
Lavare l'area interessata con sapone morbido e acqua. Elimina tutti i vestiti contaminati.
Occhi
Lava gli occhi con acqua, sbattendo le palpebre spesso per diversi minuti. Rimuovere le lenti a contatto nel caso in cui li abbia e continua a risciacquare.
Può servirti: crociera per crogiolo: caratteristiche, funzioni, usa esempiMisure antincendio
Infiammabilità
Non infiammabile.
Mezzi di estinzione
Reagire con l'acqua. Non usare l'acqua: utilizzare CO₂, sabbia e estintore.
Procedura di combattimento
Usa un apparato di respirazione autonoma con protezione completa. Indossa abiti per evitare il contatto con la pelle e gli occhi.
Riferimenti
- Salute e rischi.com, (s.f), definizione, concetti e articoli su salute, rischi e ambiente. Recuperato: salute e rischi.com
- Solfuro di alluminio. (S.F). In Wikiwand. Estratto il 9 marzo 2018: Wikiwand.com
- Elementi web.(S.F).Dialuminium Trisulpfide, recuperato il 10 marzo 2018: WebElements.com
- LTS Research Laboratories, Inc (2016), Scheda dati di sicurezza Solfuro di alluminio: LTSchem.com

