Triplo punto
- 2279
- 153
- Enzo De Angelis
Qual è il triplo punto?
Lui Triplo punto È un termine nel campo della termodinamica che si riferisce alla temperatura e alla pressione in cui vi sono contemporaneamente tre fasi di una sostanza in uno stato di equilibrio termodinamico. Questo punto esiste per tutte le sostanze, sebbene le condizioni in cui si raggiungono variano notevolmente tra ciascuna.
Un triplo punto può anche coinvolgere più di una fase dello stesso tipo per una sostanza specifica; Cioè, si osservano due diverse fasi solide, fluide o di gas. L'elio, in particolare il suo isotopo di elio-4, è un buon esempio di triplo punto che coinvolge due singoli fasi fluide: fluido normale e superfluo.
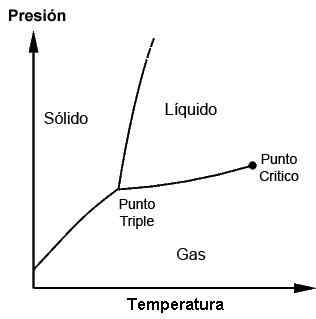
 Diagramma di fase che mostra il triplo punto e il punto critico
Diagramma di fase che mostra il triplo punto e il punto critico A cosa serve e quando viene utilizzato il triplo punto?
Il triplo punto di acqua viene utilizzato per definire il Kelvin, l'unità di base di temperatura termodinamica nel sistema delle unità internazionali (SI). Questo valore è impostato per definizione anziché misura.
I punti tripli di ciascuna sostanza possono essere osservati con l'uso di diagrammi di fase, che sono grafici tracciati che consentono di dimostrare le condizioni limitanti delle fasi solide, liquide, gassose (e altri, in casi speciali) di una sostanza mentre esercitano cambiamenti in temperatura, pressione e/o solubilità.
Una sostanza può essere trovata nel suo punto di fusione in cui il solido incontra il liquido; Può anche essere trovato nel suo punto di ebollizione in cui il liquido incontra il gas. Tuttavia, è al triplo punto in cui si ottengono le tre fasi. Questi diagrammi saranno diversi per ogni sostanza, come si vedrà più avanti.
Può servirti: gravità API: scala e classificazione del greggioIl triplo punto può essere utilizzato in modo efficace nella calibrazione dei termometri, usando le cellule a triplo punto.
Questi sono campioni di sostanze in condizioni isolate (all'interno di "cellule di vetro) che si trovano al loro triplo punto con condizioni di temperatura e pressione note e quindi facilitano lo studio della precisione delle misurazioni del termometro.
È stato anche usato lo studio di questo concetto nell'esplorazione del pianeta Marte, in cui il livello del mare è stato tentato durante le missioni che sono state eseguite negli anni '70.
Tripla acqua
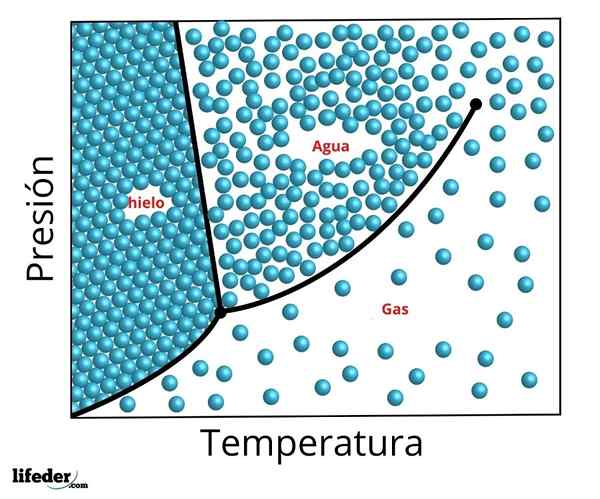 Diagramma di fase del triplo punto d'acqua. Il triplo punto è il punto inferiore e il critico il punto superiore
Diagramma di fase del triplo punto d'acqua. Il triplo punto è il punto inferiore e il critico il punto superiore Le condizioni precise di pressione e temperatura a cui l'acqua coesiste nelle sue tre fasi in equilibrio - acqua liquida, ghiaccio e vapore - si verificano ad una temperatura di esattamente 273,16 K (0,01 ºC) e una pressione parziale di vapore di vapore 611.656 PASCALS (0,00603659 atm. ).
A questo punto è possibile convertire la sostanza in una delle tre fasi con variazioni minime nella sua temperatura o pressione. Anche quando la pressione totale del sistema potrebbe essere posizionata sopra quella richiesta per il triplo punto, se la pressione parziale del vapore è a 611.656 pa, il sistema raggiungerà il triplo punto allo stesso modo.
È possibile osservare nella figura precedente la rappresentazione del triplo punto (o Triplo punto, in inglese) di una sostanza il cui diagramma è simile a quello dell'acqua, in base alla temperatura e alla pressione necessaria per raggiungere questo valore.
Nel caso dell'acqua, questo punto corrisponde alla pressione minima alla quale può esistere acqua liquida. Per pressioni minori a questo triplo punto (ad esempio, nel vuoto) e quando viene utilizzato un riscaldamento a pressione costante, il ghiaccio solido si convertirà direttamente in vapore acqueo senza passare attraverso il liquido; Questo è un processo chiamato sublimazione.
Può servirti: teoria del big bang: caratteristiche, fasi, prove, problemiOltre a questa pressione minima (PTp), il ghiaccio si scioglie per prima per formare acqua liquida e solo lì evapora o bollirà per formare vapore.
Per molte sostanze il valore di temperatura nel suo triplo punto è la temperatura minima in cui può esistere la fase liquida, ma ciò non accade nel caso dell'acqua. Per l'acqua ciò non accade, poiché il punto di fusione del ghiaccio diminuisce in base alla pressione, come mostrato con la linea tratteggiata verde della figura precedente.
In fasi ad alta pressione, l'acqua ha un diagramma di fase abbastanza complesso, che mostra quindici fasi di ghiaccio note (a diverse temperature e pressioni), oltre a dieci diversi tripli punti che vengono visualizzati nella figura seguente:
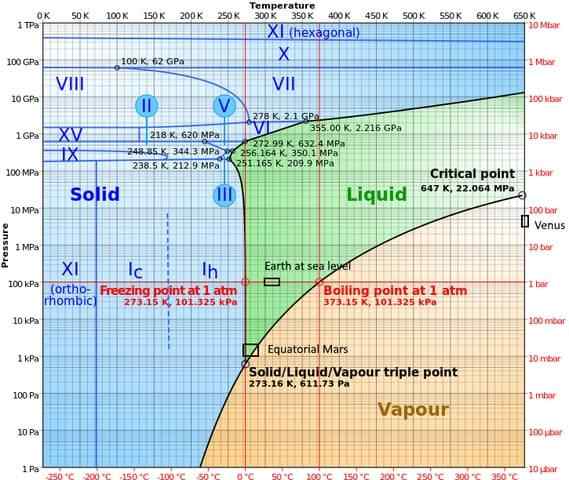
Si può notare che, in condizioni di alta pressione, il ghiaccio può esistere in equilibrio con il liquido; Il diagramma mostra che i punti di fusione aumentano con la pressione. A basse temperature costanti e aumento della pressione, il vapore può essere trasformato direttamente in ghiaccio, senza passare attraverso la fase liquida.
Le diverse condizioni che si verificano sui pianeti in cui il triplo punto (terra in mare e nell'area equatoriale di Marte) sono rappresentate anche in questo diagramma).
Il diagramma chiarisce che il triplo punto varia a seconda della posizione per motivi di pressione e temperatura atmosferica e non solo per intervento dello sperimentatore.
Triplo punto di cicloesano
Il cicloesano è un ciclocano che ha la formula molecolare di c6H12. Questa sostanza ha la peculiarità di avere condizioni a triplo punto che possono essere facilmente riprodotte, come nel caso dell'acqua, poiché questo punto si trova a una temperatura di 279,47 K e una pressione di 5.388 kPa.
Può servirti: cariche dal vivo: concetto, caratteristiche, esempiIn queste condizioni, è stato osservato il composto Hirar, la solidificazione e lo scioglimento con cambiamenti minimi di temperatura e pressione.
Triple Benzene Point
In un caso simile al cicloesano, benzene (composto organico con formula chimica C6H6) ha condizioni triple punti facilmente riproducibili in un laboratorio.
I suoi valori sono 278,5 K e 4,83 kPa, quindi anche la sperimentazione con questo livello principiante è comune.
Riferimenti
- Wikipedia. (S.F.). Wikipedia. Ottenuto da in.Wikipedia.org
- Britannica, e. (1998). Britannica Enciclopedia. Ottenuto dalla Britannica.com
- Potenza, n. (S.F.). Potenza nucleare. Ottenuto dal potere nucleare.netto
- Wagner, w., Saul, a., & Prub, a. (1992). Equazioni internazionali per la pressione lungo lo scioglimento e lungo la curva di sublimazione dell'acqua ordinaria. BOCHUM.
- Penoncello, s. G., Jacobsen, r. T., & Goodwin, a. R. (1995). Alla formulazione della proprietà termodinamica per il cicloesano.

