Struttura di solfato di manganese (MNSO4), proprietà, ottenimento, usi

- 4779
- 34
- Dante Morelli
Lui Solfato di manganese (II) È un solido inorganico formato dagli elementi di manganese (MN), zolfo (S) e ossigeno (O). La sua formula chimica è MSO4. La sua forma anidra (senza acqua nella sua struttura) è un solido bianco. Tuttavia, ha diverse forme idratate e tutte sono solidi rosa.
Il solfato di manganese in quantità molto piccole (minuscole) viene utilizzata come micronutriente sia per gli animali che per l'uomo, poiché è necessario per il normale funzionamento dell'organismo.
 Manganese Solfato anhidro Mnso4. YOSF0113 presso l'inglese Wikipedia / Public Domain. Fonte: Wikimedia Commons.
Manganese Solfato anhidro Mnso4. YOSF0113 presso l'inglese Wikipedia / Public Domain. Fonte: Wikimedia Commons. Viene inoltre sommato insieme ad alcuni fertilizzanti in terreni carenti di manganese (MN) per colture agricole che ne hanno bisogno, come le piante d'uva.
A causa della colorazione rosa delle sue varietà idratate, viene utilizzato nei pigmenti che servono a dipingere ceramiche, tessuti da colorare e altri materiali. Serve anche per ottenere altri composti di manganese.
I mons4 deve essere manipolato con cura. La sua inalazione può causare problemi respiratori e produrre gravi inconvenienti nel sistema nervoso, che includono sintomi simili alla malattia di Parkinson.
Il suo eccesso può anche causare danni alla terra e agli animali acquatici e alle piante.
[TOC]
Struttura
Il solfato di manganese anidro (senza acqua nella sua struttura cristallina) è formato da uno ione di manganese nell'ossidazione +2, cioè MN2+ e un anione di solfato così42-.
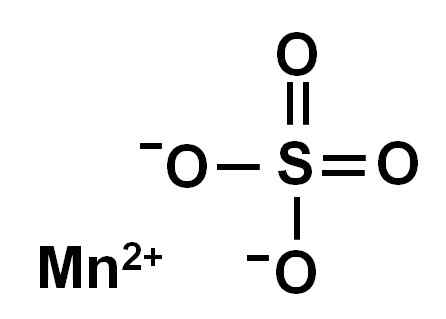 Struttura chimica del solfato di manganese4. Autore: Marilú Stea.
Struttura chimica del solfato di manganese4. Autore: Marilú Stea. Nomenclatura
- Solfato di manganese (II)
- Monosulfato di manganese
- Manganese Solfato anhidro Mnso4
- Manganese Manganese Solfato MSSO4 •H2O
- Tetraidrato Manganese Solfato MSO4 •4h2O
- Solfato di manganese pentaidrato4 •5h2O
- Solfato di manganese eptidratato4 •7h2O
Proprietà
Stato fisico
I mons4 Anidro (senza acqua nella sua struttura) è un solido bianco cristallino. Tuttavia, le varietà idratate sono solidi rosa o rosso pallido.
 Manganeso solfato tetraidrato mnso4.4h2O è un solido rosa. Benjah-bmm27 / dominio pubblico. Fonte: Wikimedia Commons.
Manganeso solfato tetraidrato mnso4.4h2O è un solido rosa. Benjah-bmm27 / dominio pubblico. Fonte: Wikimedia Commons. Peso molecolare
MSSO4 = 151 g/mol
MSSO4 •H2O = 169,02 g/mol
Punto di fusione
MSSO anidro4 = 700 ºC
Monoidrato MSO4 •H2O = 400-450 ° C
Mensa tetraidrato4 •4h2O = 30 ° C
Punto di ebollizione
MSSO anidro4 = Si decompone a 850 ºC.
Può servirti: cloruro di cobalto (COCL2 (: struttura, nomenclatura, proprietàMensa tetraidrato4 •4h2O = 850 ° C
Densità
MSSO4 = 3,25 g/cm3
MSSO4 •H2O = 2,95 g/cm3
Solubilità
Molto solubile in acqua: 52 g/100 ml di acqua a 5 ° C. Alcol solubile. Insolubile in etere. Leggermente solubile in metanolo.
ph
Una soluzione monse4 •H2O il 5% ha un pH di 3,7.
Proprietà chimiche
Quando si dissolve in acqua, l'MNSO4 viene separato nei suoi ioni Mn2+ E così42-.
Lo ione manganese (ii) mn2+ In una soluzione acida o neutra è collegato a 6 molecole d'acqua2O formando lo ione esaeaacuomanganese [Mn (H2O)6"2+, che è rosa.
Lo ione esaaacuomanganese [MN (H2O)6"2+ È abbastanza resistente all'ossidazione. Nel mezzo di base (pH alcalino) questo ione diventa idrossido di manganese (II) Mn (OH)2, che è facilmente ossidato, formando composti di manganese (III) e manganese (IV).
 Soluzioni MSSO4 Gli acidi sono rosa per la presenza dell'ione hexaacuomanganese [Mn (H2O)6"2+. Autore: Steve Cross. Fonte: Pixabay.Il solfato di manganese ha diverse forme idratate, cioè con acqua H2O nella sua struttura cristallina.
Soluzioni MSSO4 Gli acidi sono rosa per la presenza dell'ione hexaacuomanganese [Mn (H2O)6"2+. Autore: Steve Cross. Fonte: Pixabay.Il solfato di manganese ha diverse forme idratate, cioè con acqua H2O nella sua struttura cristallina.
Questi sono mono mono4 •H2Oppure, tetrahydrate MSO4 •4h2Oppure, pentaidrato MNSE4 •5h2O ed Hepthydrate MSO4 •7h2O. Queste forme idratate contengono lo ione esaeaacuomanganese [Mn (H2O)6"2+ Nei loro cristalli e per questo motivo sono solidi rosa.
Il mensole monoidrato4 •H2Oppure è leggermente efflorescente, il che significa che perde lentamente parte della sua idratazione quando è esposta all'ambiente.
Ottenimento
I mons4 Può essere ottenuto trattando l'ossido di manganese (II) MNO, Mn Manghanous Idroxide (OH)2 O carbonato di manganese (ii) MNCO3 Con acido solforico H2SW4.
Mnco3 + H2SW4 → MSSO4 + H2O + co2
Applicazioni
Come complemento nutrizionale
Il solfato di manganese in piccole quantità serve alcune funzioni del corpo e degli animali umani.
Ecco perché è importante come un utile composto nella nutrizione ed è fornito come integratore alimentare. È usato in tracce (quantità estremamente piccole).
Le alte quantità possono essere molto tossiche e dannose.
Nella medicina veterinaria
I mons4 Gli uccelli corrali (polli, tacchini, anatre e faisani) vengono somministrati per prevenire la carenza o la mancanza di elementi di manganese in questi animali.
Può servirti: Iodate di potassio (Kio3)La mancanza di manganese si manifesta in essi, ad esempio, come la malattia chiamata perosi, che è la deformazione delle ossa delle gambe giovani uccelli.
 I patitos possono richiedere tracce di Monste4 Nella sua dieta per prevenire la perosi. Autori: s. Hermann e F. Richter. Fonte: Pixabay.
I patitos possono richiedere tracce di Monste4 Nella sua dieta per prevenire la perosi. Autori: s. Hermann e F. Richter. Fonte: Pixabay. Si applica all'alimentazione di questi uccelli in quantità o tracce molto piccole.
In agricoltura
Il solfato di manganese è usato come micronutriente nei fertilizzanti per viti (piante d'uva) e piantagioni di tabacco in carenti carenti in manganese.
Tuttavia, alcuni studi indicano che l'eccesso di solfato di manganese può inibire o ridurre la formazione di alcuni importanti enzimi per la crescita delle piante e dei loro focolai.
 In alcuni casi applica Mnso4 a terra dove si trovano le piante d'uva. Autore: Schwoaze. Fonte: Pixabay.
In alcuni casi applica Mnso4 a terra dove si trovano le piante d'uva. Autore: Schwoaze. Fonte: Pixabay. Ad esempio, è stato scoperto che è tossico per alcune colture come il cotone.
I mons4 Ha anche uso in fungicidi e insieme ad alcuni composti organici fa parte di alcuni pesticidi.
In diverse applicazioni
I mons4 Idratato viene utilizzato dalla sua colorazione per preparare pigmenti inorganici utilizzati nelle vernici rosse per la ceramica, in tessuti e altri coloranti per materiali.
Il solfato di manganese viene utilizzato nella produzione di vetro e i saponi sono anche preparati con esso.
 Alcune piastrelle in ceramica possono contenere pigmenti di solfato di manganese. Autore: Dwilliams. Fonte: Pixabay.
Alcune piastrelle in ceramica possono contenere pigmenti di solfato di manganese. Autore: Dwilliams. Fonte: Pixabay. I mons4 È il materiale di partenza per ottenere il metallo di manganese (MN) elettrolitico, cioè applicando l'elettricità a soluzioni acquose.
Ti consente anche di ottenere il biossido di manganese2 e carbonato di manganese3.
I mons4 Viene anche utilizzato per l'analisi chimica e nella formulazione di soluzioni utilizzate negli esperimenti di genetica con microrganismi.
Rischi
Il solfato di manganese contiene lo ione di manganese (II) (MN2+), che può essere sia innocuo che tossico a seconda delle quantità a cui sono esposti la persona, l'animale o la pianta.
Il manganese è essenziale per il normale funzionamento dell'organismo di umani, animali e alcune piante. Ma sfortunatamente il manganese è anche neurotossico, cioè colpisce il sistema nervoso e alcune funzioni vegetali.
Può servirti: chi ha progettato il primo termometro moderno?Importi apparentemente sicuri
I mons4 somministrato con alimenti a forma di cibo (quantità estremamente piccole o minuscole) è generalmente sicuro dall'amministrazione di cibo e farmaci o FDA (acronimo di inglese Food and Drug Administration).
Importi pericolosi
L'esposizione prolungata o ripetuta a questo composto in quantità apprezzabili può causare danni all'essere umano e agli animali.
Produce irritazione agli occhi mucosi e alle mucose del tratto respiratorio, dell'anoressia, del mal di testa, della perdita di equilibrio, della polmonite e delle infezioni respiratorie.
L'inalazione cronica provoca danni al sistema nervoso, generando manghanismo, tremore nelle mani tipiche e nei sintomi della malattia di Parkinson.
 Il solfato di manganese colpisce il sistema nervoso. Autore: Sabine Zierer. Fonte: Pixabay.
Il solfato di manganese colpisce il sistema nervoso. Autore: Sabine Zierer. Fonte: Pixabay. Pertanto, la dispersione della polvere MSO dovrebbe essere evitata4, Usa attrezzatura per respirare e guanti protettivi.
È tossico per la vita acquatica e in questo genera effetti a lungo termine. Deve essere conservato in luoghi in cui non c'è accesso al sistema di drenaggio o fognatura. È molto importante non permettere che venga scartato nell'ambiente.
Riferimenti
- O.S. Biblioteca nazionale di medicina. (2019). Manganese solfato. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- L'enciclopedia di chimica industriale di Ullmann. (1990). Quinta edizione. Volume A22. VCH Verlagsgellschaft MBH.
- O.S. Biblioteca nazionale di medicina. (2019). Monganese Solfato monoidrato. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Dunham, m.J. (2010). Guida alla genetica Yast: genomica funzionale, proteomica e altre analisi dei sistemi. Formulazione media. In metodi in enzimologia. Recuperato da ScienceDirect.com.
- Saric, m. e Lucchini, r. (2007). Manganese. Usate. Nel manuale sulla tossicologia dei metalli (terza edizione). Recuperato da ScienceDirect.com.
- Vallero, d. (2014). Effetti neurologici dei poltanti dell'aria. Manganese. In fondi di inquinamento atmosferico (quinta edizione). Recuperato da ScienceDirect.com.
- Allegria. (1986). In vitro Cultura di Vitis: Gli effetti dello spettro chiaro solfato di manganese e ioduro di potassio sulla morfogenesi. Cull di cellule vegetali, tiss e organi 7: 121-134 (1986). Link recuperato.Springer.com.
- « Struttura secbutile, caratteristiche, nomenclatura, formazione
- +125 detti brevi e popolari [con significato] »

