Solfato di ammonio
- 3635
- 580
- Silvano Montanari
Spieghiamo cos'è il solfato di ammonio, la sua struttura chimica, le proprietà fisiche e chimiche e gli usi
Cos'è il solfato di ammonio?
Lui solfato di ammonio È un sale ternario e ammoniaca inorganico di acido solforico. La sua formula chimica è (NH4)2SW4. Pertanto, le proporzioni stechiometriche affermano che per ogni anione solfato ci sono due cationi di ammonio che interagiscono con lui. Ciò consente la neutralità del sale ((+1) ∙ 2 + (-2)).
La sua nomenclatura è dovuta al fatto di essere un sale derivato da H2SW4, Cambiare il suffisso "urico" per "ato". Pertanto, i due protoni iniziali sono sostituiti da NH4+, Prodotto della reazione con ammoniaca (NH3). Quindi, l'equazione chimica per la sua sintesi è: 2 NH3 + H2SW4 => (NH4)2SW4
Il solfato di ammonio viene anche preparato mediante reazione di carbonato di ammonio con solfato di calcio: (NH4)2Co3 + Caso4 => (NH4)2SW4 + Ladro3, precipitando il carbonato di calico, che è separato dal liquido rimanente.
Il solfato di ammonio è accumulo di azoto e zolfo, sia indispensabile nella chimica del suolo e nei fertilizzanti.
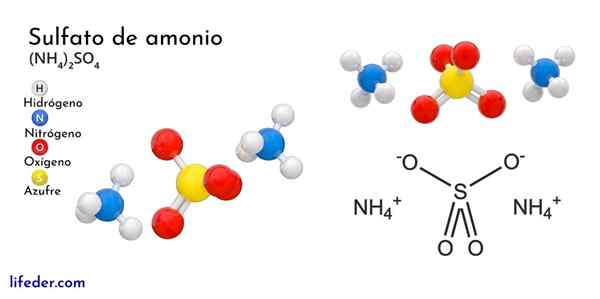
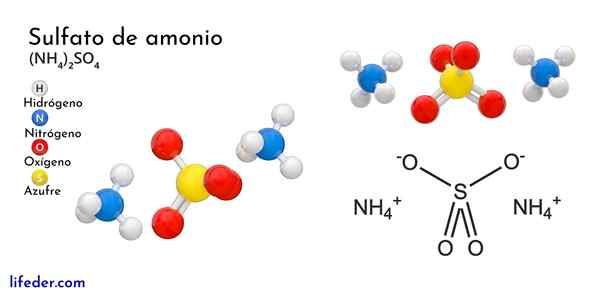
Struttura chimica del solfato di ammonio

L'immagine superiore illustra le geometrie molecolari degli ioni NH4+ E così42-. Le sfere rosse corrispondono agli atomi di ossigeno, agli atomi di idrogeno da bianco a idrogeno, atomo di azoto e azoto e atomo di giallo a zolfo.
Entrambi gli ioni possono essere considerati come due tetraedri, con tre unità che interagiscono per formare una disposizione cristallina ortorrombica. L'anione solfato è così42- Ed è in grado di donare o accettare quattro ponti idrogeno, nonché il catione NH4+.
Proprietà di solfato di ammonio
Peso molecolare
132.134 g/mol.
Può servirti: relazione tra chimica e tecnologia con essere umano, salute e ambienteAspetto fisico
Solido bianco. Cristalli ortorrombici ortorrombici bianchi o marroni, a seconda dei livelli di impurità.
Odore
Gabinetto.
Punto di fusione
280 ºC. Questo punto di fusione, sotto altri composti ionici, è perché è un sale con cationi monovalenti (+1) e con ioni travestimenti nelle sue dimensioni, facendo sì che il solido abbia un'energia reticolare a bassa cristallina.
Solubilità
76,4 g/100 g di acqua a 25 ° C. Questa affinità per l'acqua è dovuta alla grande capacità delle loro molecole di risolvere gli ioni di ammonio. D'altra parte, è insolubile in acetone e alcol; cioè, in meno solventi polari dell'acqua.
Densità
1,77 g/cm3 a 25 ºC.
Pressione del vapore
1.871 kPa a 20 ºC.
punto d'infiammabilità
26 ºC.
ph
5,0 - 6,0 (25 ºC. Soluzione 1 m). Il pH leggermente acido è dovuto all'idrolisi NH4+ In acqua, producendo h3O+ a basse concentrazioni.
Stabilità
Stabile in condizioni ambientali adeguate. In contatto con solidi ossidanti può dare fuoco.
Decomposizione
Comincia a decomporre a 150 ºC, rilasciando vapori tossici di ossido di zolfo, ossido di azoto e ammonio.
Corrosione
Non attacca ferro o alluminio.
Usi del solfato di ammonio
In agricoltura
- Il solfato di ammonio viene usato come fertilizzante nei terreni alcalini. Il sale di ammonio ha il 21 % di azoto e il 24 % di zolfo nella sua composizione. Tuttavia, ci sono composti che forniscono una quantità di azoto maggiore del solfato di ammonio; Il vantaggio di quest'ultimo è la sua alta concentrazione di zolfo.
- Lo zolfo è essenziale nella sintesi proteica, poiché diversi aminoacidi - come cistina, metionina e cisteina - hanno lo zolfo. Per questi motivi, il solfato di ammonio continua ad essere uno dei fertilizzanti più importanti.
- È usato in colture di grano, mais, riso, cotone, patate, canapa e frutta.
- Il pH dei terreni alcalini verso il basso per il loro contributo nel processo di nitrificazione effettuato dai microbi. Viene utilizzato l'ammonio (NH4+) per produrre nitrati (no3-) e rilascio h+: 2nh4+ + 4 °2 => 2no3- + 2h2O + 4h+. L'aumento della concentrazione di idrogeno riduce il pH dei terreni alcalini e consente un maggiore utilizzo.
- Oltre al suo uso come fertilizzante, il solfato di ammonio funge da adiuvante di insetticidi solubili, erbicidi e fungicidi, che vengono spruzzati su colture.
- Il solfato è in grado di rapire gli ioni presenti nel suolo e nell'irrigazione che sono necessarie per la vita di alcuni agenti patogeni. Tra gli ioni che le catturano il solfato di ammonio ci sono la CA2+, Il mg2+, fede2+ e fede3+. Questa azione migliora l'effetto microbicida degli agenti di cui sopra.
Come reagente analitico
Il solfato di ammonio funge da agente precipitante nell'analisi elettrochimica, nel mezzo della coltura microbiologica e nella preparazione dei sali di ammonio.
In precipitazione e isolamento proteico
Il solfato di ammonio viene utilizzato nell'isolamento e nella purificazione delle proteine, in particolare il plasma. Al plasma viene aggiunta una quantità di solfato di ammonio per portarlo a una certa concentrazione; Pertanto, la precipitazione di un gruppo proteico è causata.
Viene raccolto il precipitato mediante centrifugazione e il surnatante viene aggiunto un'ulteriore quantità di solfato di ammonio e, a una nuova concentrazione, viene prodotta la precipitazione di un altro gruppo di proteine.
La ripetizione del processo precedente consente di ottenere diverse frazioni di proteine plasmatiche.
Prima che appaiano le nuove tecnologie della biologia molecolare, questa procedura ha permesso all'isolamento delle proteine plasmatiche di grande importanza in medicina, ad esempio: immunoglobuline, fattori di coagulazione, ecc.
Nell'industria
L'ammonio solfato agisce ritardando l'inizio del fuoco nell'industria tessile. È usato come additivo nel settore dell'elettroanchapado. Viene anche usato nella produzione di perossido di idrogeno, cloruro di ammonio, ecc.
Altri usi
- Il solfato di ammonio viene usato come agente regolatorio della pressione osmotica e come agente precipitante dei sali.
- Sotto forma di solfato di ammonio, riduce la tensione superficiale dell'acqua, consentendo così la separazione degli inquinanti da un aumento della durezza dell'acqua.
- È un agente anticorrosivo.
- È usato come additivo alimentare che regola l'acidità nella pasta e nel pane.
- « Missione e concetto di visione personale, come farli, esempi
- Sali successivi cosa sono, nomenclatura, proprietà, esempi »