Concetto, processo ed esempi di sublimazione
- 4043
- 1023
- Enzo De Angelis
IL sublimazione È un processo termodinamico in cui un cambiamento di stato endotermico si verifica direttamente da un solido a un gas, senza la precedente formazione del liquido. Un eccezionale esempio di questo processo è quello del ghiaccio secco; Se esposto al sole o immerso in un liquido, passa direttamente dal solido a stato gassoso.
Il comportamento del solido in condizioni normali è quello di riscaldarsi e originare una prima goccia, dove particelle più solide si dissolvono fino a quando non si scioglie completamente. Nel frattempo, in sublimazione si parla di una "bolla", di un vapore progressivo senza bagnare la superficie che tocca, ma immediatamente depositato o cristallizza.
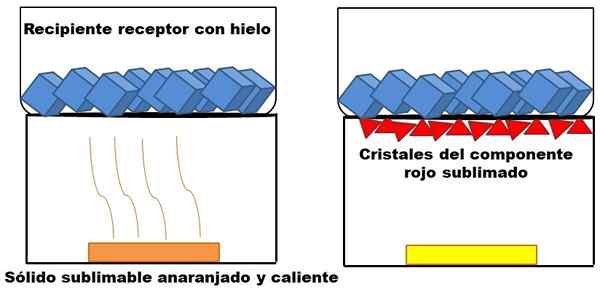
 Esempio di sublimazione di un ipotetico solido arancione. Fonte: Gabriel Bolívar.
Esempio di sublimazione di un ipotetico solido arancione. Fonte: Gabriel Bolívar. Ciò che è descritto nel paragrafo superiore è rappresentato nell'immagine superiore. Supponiamo che una miscela solida arancione (a sinistra), che inizia ad aumentare la sua energia aumentando la temperatura. Il componente rosso sublimale, e quindi depositato nella parte inferiore del contenitore ricevente, la cui temperatura è inferiore a causa di cubetti di ghiaccio nel suo contenuto.
I triangoli rossi o i cristalli vengono depositati grazie alla superficie fredda di questo contenitore (a destra), che assorbe la sua temperatura; E anche se non è mostrato, la dimensione dei suoi cubi di ghiaccio deve diminuire a causa dell'assorbimento del calore. Il solido rimanente ha un componente giallo non pubblicabile in condizioni di processo.
[TOC]
Concetto di sublimazione
Processi
È già stato detto che la sublimazione è un cambiamento di stato endotermico, perché per questo, deve esserci assorbimento del calore. Se il solido assorbe il calore, la sua energia aumenterà, quindi le sue particelle vibrano anche a frequenze maggiori.
Quando queste vibrazioni diventano molto forti, finiscono per colpire interazioni intermolecolari (non legami covalenti); E di conseguenza, prima o poi le particelle prenderà più distanze l'una dall'altra, fino a quando non riusciranno a fluire e muoversi più liberamente attraverso le regioni dello spazio.
Può servirti: regola diagonaleIn alcuni solidi le vibrazioni sono così forti, che alcune particelle sono "innescate" al di fuori della struttura invece di agglomerazione in cluster mobili che definiscono una goccia. Queste particelle sfuggono e integrano la prima "bolla", che preferirebbe formare i primi vapori del solido sublimizzato.
Non si parla quindi di un punto di fusione, ma di una sublimazione. Mentre entrambi dipendono dalla pressione regnante dal solido, il punto di sublimazione è più; Pertanto, la sua temperatura varia notevolmente con le variazioni di pressione (come nel caso del punto di ebollizione).
Dalla struttura solida al disturbo del gas
In sublimazione si dice anche che vi sia un aumento dell'entropia del sistema. Gli stati energetici delle particelle vanno dall'essere limitati dalle loro posizioni fisse nella struttura solida, per omogeneizzare nelle loro direzioni capricciose e caotiche nello stato gassoso, più uniforme, dove finalmente acquisiscono un'energia cinetica media.
Diagramma di fase e triplo punto
Il punto di sublimazione dipende dalla pressione; Perché altrimenti, le particelle solide assorbirebbero il calore per non essere sparato nello spazio al di fuori del solido, ma per formare gocce. Non sarebbe sublimato, ma si scioglierebbe o si scioglierebbe, come è il più solito.
Maggiore è la pressione esterna, meno è probabile che la sublimazione sarà, poiché il solido da sciogliere è obbligato.
Ma quali solidi sono sublimabili e quali no? La risposta sta nei diagrammi delle fasi p vs t, come mostrato di seguito:
Può servirti: neon: storia, proprietà, struttura, rischi, usi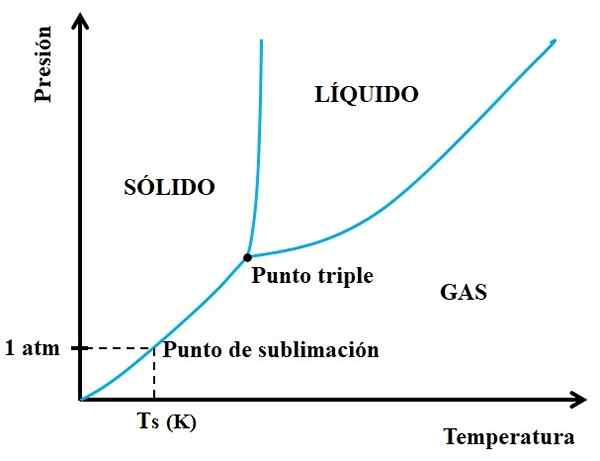 Diagramma di fase per una sostanza ipotetica. Fonte: Gabriel Bolívar.
Diagramma di fase per una sostanza ipotetica. Fonte: Gabriel Bolívar. Devi guardare prima il triplo punto e percorrere il tratto inferiore: quello che separa gli stati solidi e gassosi. Si noti che nella regione solida, ci deve essere una diminuzione della pressione in modo che si verifichi la sublimazione (non necessariamente 1 pressione atmosferica). Un 1 atm, la sostanza ipotetica Sublim sarà a una temperatura TS espressa in k.
Più e più lunga è la sezione o la curva sotto il triplo punto, maggiore è la capacità del solido di sublim a temperature diverse; Ma se è ben al di sotto di 1 atm, sarà necessario con lacune elevate per raggiungere la sublimazione, in modo che le pressioni siano ridotte (0,0001 atm, ad esempio).
Condizioni
Se il triplo punto è migliaia di volte inferiore alla pressione atmosferica, il solido non subisce mai o addirittura applicherà ultra -vita (per non parlare della sua suscettibilità al decomporre dall'azione del calore).
Se questo non è il caso, le sublimazioni vengono eseguite per mezzo di moderatamente e presentando il solido per aspirare in modo che le loro particelle sfuggano più facilmente, senza la necessità di assorbire così tanto calore.
La sublimazione diventa molto importante quando sono particolarmente solidi con alta pressione del vapore; cioè, la pressione all'interno, il riflesso dell'efficienza delle sue interazioni. Maggiore è la sua pressione del vapore, più è odoroso e anche più sublimabile.
Esempi
Purificazione solida
L'immagine del solido arancione e il suo componente rossastro sublimabile è un esempio di ciò che la sublimazione rappresenta per quanto riguarda la solida purificazione. I triangoli rossi possono essere riassunti tutte le volte necessarie fino a quando è garantita un'alta purezza.
Può servirti: spatola di laboratorioQuesta tecnica viene utilizzata principalmente con solidi profumati. Ad esempio: canfora, caffeina, benzoine e mentolo.
Tra gli altri solidi che possono sottolineare la sublimazione: iodio, ghiaccio (a grandi altitudini), teobromina (cioccolato), saccarina, morfina e altri farmaci, basi di azoto e antracene.
Sintesi cristallina
Tornando ai triangoli rossi, la sublimazione offre un'alternativa alla cristallizzazione convenzionale; I cristalli non saranno più sintetizzati da una soluzione, ma per mezzo.
Diciamo, se hanno quadrati rossi, la crescita dei cristalli manterrà questa geometria e non dovrebbe diventare triangolare. I quadrati rossi cresceranno gradualmente man mano che si svolge la sublimazione. Tuttavia, è un complesso operativo e molecolare complesso, in cui si vedono molte variabili coinvolte.
Esempi di cristalli sintetizzati tramite sublimazione sono: carburo di silicio (sic), grafite, arsenico, selenio, fosforo, nitruro di alluminio (ALN), solfuro di cadmio (CDS), zinco selenio (Znse), Mercury Iodide (HGI2), grafene, tra gli altri.
Si noti che sono in realtà due fenomeni compeneriti: sublimazione progressiva e deposizione (o sublimazione inversa); Il vapore emigra dalle regioni o dalle superfici solide a più fredde, per depositare finalmente sotto forma di cristalli.
Temi di interesse
Esempi di sublimazione.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Wikipedia. (2019). Sublimazione (transizione di fase). Recuperato da: in.Wikipedia.org
- Jones, Andrew Zimmerman. (27 gennaio 2019). Sublimazione. Recuperato da: Thoughtco.com
- Sheila Morrissey. (2019). Cos'è la sublimazione in chimica? - Definizione, processo ed esami. Studio. Recuperato da: studio.com
- Elsevier b.V. (2019). Metodo di sublimazione. Scienceirect. Estratto da: ScienceDirect.com
- « Caratteristiche del subcaducifolio della foresta tropicale, flora, fauna
- Proprietà integrali integrate, applicazioni, calcolo (esempi) »

