Soluzioni per ammortizzatori

- 3444
- 43
- Benedetta Rinaldi
Spieghiamo quali sono le soluzioni di smorzamento, le loro proprietà, componenti, tipi e forniscono diversi esempi
 Le soluzioni di ammortizzatore regolano il pH attorno a un valore specifico
Le soluzioni di ammortizzatore regolano il pH attorno a un valore specifico Cosa sono le soluzioni di smorzamento?
IL Soluzioni per ammortizzatori, Chiamati anche tamponi, regolatori di pH o tamponi, sono soluzioni acquose formate da acido debole e dalla sua base coniugata o da una base debole e dal suo acido coniugato.
Sono chiamati soluzioni di ammortizzatore, poiché hanno la capacità di attutire il cambiamento di pH dopo l'aggiunta di acidi o basi in piccole quantità, anche se sono acidi o basi forti.
Le soluzioni di ammortizzatore sono molto utili, poiché consentono al pH di essere costanti. Ci sono molte reazioni chimiche che richiedono un pH specifico e costante per funzionare bene.
Proprietà delle soluzioni morpainary
Sono soluzioni acquose
Sia il concetto di pH che la scala del pH hanno senso solo nelle soluzioni acquose, quindi tutti i tamponi o le soluzioni di smorzamento sono preparate in acqua.
La sua operazione si basa sull'equilibrio acido-base e sui principi di Le Chatlier
I tamponi si basano su reazioni di dissociazione acido/base reversibili che sono in equilibrio. Aggiungendo acidi o basi forti all'ambiente, questo equilibrio è disturbato, quindi il sistema reagisce per contrastare il disturbo, seguendo i principi del catenale Le. Ecco come i buffer riescono a attutire i grandi cambiamenti nel pH.
Il tuo pH è facilmente calcolato con l'equazione di Henderson-Haselbalch
Indipendentemente dal tipo di soluzione di ammortizzatore, il suo pH sia prima che dopo aver aggiunto piccole quantità di acidi o basi forti, può essere calcolato mediante l'equazione di Henderson-Hohaselbalch:
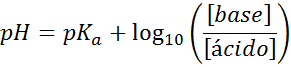
Dove [la base] si riferisce alla concentrazione molare della base (o del sale della base coniugata) e [acido] si riferisce alla concentrazione molare dell'acido (o del sale dell'acido coniugato).
Può servirti: materiali elasticiSono in grado di neutralizzare parzialmente sia gli acidi che le basi
Le soluzioni di smorzamento sono costituite da una sostanza di base e da una sostanza acida, che può neutralizzare le basi e gli acidi, rispettivamente. Per questo motivo, possono attutire il pH dopo l'aggiunta di acidi forti e basi forti.
Il suo funzionamento dipende dalla temperatura
Il pH di una soluzione tampone dipende dall'acidità o dalla costante di base dell'acido o della base debole che contiene. Questa costante dipende dalla temperatura, quindi il funzionamento di queste soluzioni dipende anche dalla temperatura.
Più concentrato, maggiore è la sua capacità di attutire o regolare il pH
La capacità di smorzamento dipende dalla concentrazione totale della soluzione è maggiore della concentrazione finale dell'acido o della base forte che viene aggiunta. Per questo motivo, maggiore è la concentrazione totale della soluzione tampone, maggiore è la sua capacità di cuscinare acidi o basi forti.
Componenti di una soluzione di smorzamento o tampone
Chimicamente, le soluzioni di smorzamento sono formate solo da due componenti. Questi componenti possono essere un acido debole miscelato con un sale dalla sua base coniugata o una base debole mescolata con un sale del suo acido coniugato.
Esistono due modi diversi per ottenere questi componenti nella stessa soluzione, come vedremo di seguito:
1. Preparazione di tamponi di miscelazione delle soluzioni dei suoi componenti
Questo è il modo più diretto per preparare una soluzione buffer. Per fare ciò, sono preparate soluzioni separate di acido debole (ad esempio acido acetico) e un sale di base coniugato (ad esempio acetato di sodio)). Quindi entrambe le soluzioni si mescolano gradualmente fino al pH desiderato.
Può servirti: ammonio ionico (NH4+): formula, proprietà e usi
- Le soluzioni sono miscelate a poco a poco fino a quando il pH desiderato
2. Preparazione di tamponi mediante parziale neutralizzazione di una soluzione di un acido debole
In questo caso, una soluzione acida debole viene preparata con la concentrazione totale desiderata e quindi l'idrossido di sodio o potassio viene aggiunto a poco a poco fino a raggiungere il pH desiderato.
Tipi di soluzioni buffer
Le soluzioni di ammortizzatore possono essere classificate in base ai tipi di componenti che possiedono o secondo il loro pH finale.
Secondo i tipi di componenti:
- Tampone di base debole e coniugato: In questi casi il pH dipende da PKA di acido debole.
- Tampone di base debole e acido coniugato: In questi casi, il pH dipende da PKB Debole.
- Tampone sali di acido poliprotico: In alcuni casi sia il ruolo dell'acido debole che la sua base coniugata sono entrambi sali dalla parziale neutralizzazione di un acido che ha diversi protoni come l'acido solforico o fosforico.
Secondo il suo pH finale:
A seconda dell'acidità o della costante di base, una soluzione tampone può regolare il pH attorno a diversi gamme di pH, dando origine a tre tipi di buffer:
- Tamponi acidi: Sono quelli che regolano il pH attorno a valori inferiori a 7. Sono preparati con acidi deboli il cui PKA essere meno di 7 o con basi deboli il cui PKB essere maggiore di 7.
- Tamponi neutri: Sono quelli che regolano il pH intorno a 7. Di solito sono costituiti da acidi o basi deboli che hanno un PKA o un pkB vicino a 7.
- Tamponi alcalini: Sono quelli che regolano il pH attorno a valori superiori a 7. Sono preparati con acidi deboli il cui PKA essere maggiore di 7 o con basi deboli il cui PKB è meno di 7.
Esempi di buffer o soluzioni di smorzamento
Tampone acido acetico/acetato di sodio
Questo è un tampone di un acido debole (acido acetico) e un sale della sua base coniugata (acetato di sodio). L'equilibrio coinvolto e la sua costante di equilibrio sono:
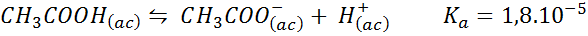
Questo buffer regola il pH in giro 4.74.
Tampone ammoniaca/cloruro di ammonio
Questo è un tampone di base debole (ammoniaca o idrossido di ammonio) e un sale del suo acido coniugato (cloruro di ammonio). L'equilibrio coinvolto e la sua costante di equilibrio sono:
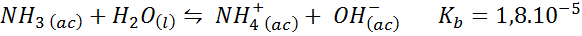
Questo è un tampone alcalino che regola il pH intorno 9.26.
Tampone bisolfato/solfato
In questo caso, lo ione bisolfato gioca la carta dell'acido debole la cui base coniugata è lo ione solfato. L'equilibrio coinvolto è:
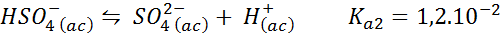
Questa è una soluzione dannosa acida che regola il pH intorno 3.05.
Tampone acido carbonico/bicarbonato
Questo è uno dei più importanti sistemi di regolazione del pH nel nostro sangue. La reazione coinvolta è: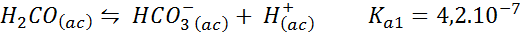
Questo buffer regola il pH in giro 6.38.
Fosfato tampone diidrogeno/idrogeno fosfato
Questo è uno dei sistemi di regolazione del pH più utilizzati in biologia e biochimica, poiché consente di regolare il pH molto vicino al pH fisiologico a cui si verificano la maggior parte delle reazioni chimiche all'interno delle cellule. La reazione è:
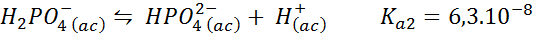
Questo buffer regola il pH in giro 7.20.

