Componenti della soluzione isotonica, preparazione, esempi
- 3834
- 701
- Baldassarre Ross
UN soluzione isotonica È uno che presenta la stessa concentrazione di soluto rispetto a una soluzione separata o isolata da un bug semipermeabile. Questa barriera consente al solvente di trans, ma non tutte le particelle di soluto.
In fisiologia, questa soluzione isolata si riferisce al fluido intracellulare, cioè l'interno delle cellule; Mentre la barriera semipermeabile corrisponde alla membrana cellulare, formata da un bilay lipidico.
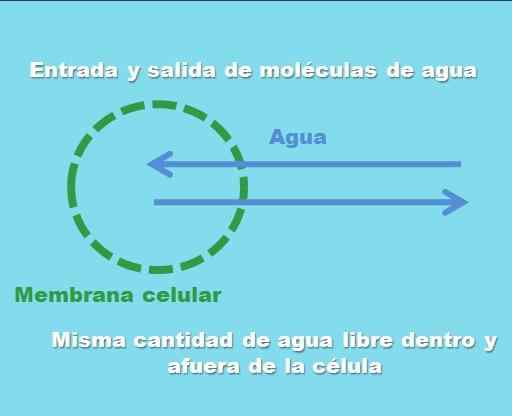
 Interazione di una cellula con una soluzione isotonica. Fonte: Gabriel Bolívar.
Interazione di una cellula con una soluzione isotonica. Fonte: Gabriel Bolívar. L'immagine superiore illustra ciò che si intende per una soluzione isotonica. La "concentrazione" dell'acqua è la stessa all'interno e all'esterno della cellula, quindi le loro molecole entrano o escono attraverso la membrana cellulare con frequenze uguali. Pertanto, se due molecole d'acqua entrano nella cellula, due di esse lasceranno simultaneamente verso il mezzo extracellulare.
Questo stato, chiamato isotonicità, si svolge solo quando il mezzo acquoso, all'interno e all'esterno della cellula, contiene lo stesso numero di particelle di soluto disciolte. Pertanto, una soluzione sarà isotonica se la concentrazione dei suoi soluti è simile a quella del fluido o del mezzo intracellulare. Ad esempio, la soluzione salina 0,9% è isotonica.
[TOC]
Componenti delle soluzioni isotoniche
Perché ci sia una soluzione isotonica, deve prima garantire che l'osmosi si verifichi nella soluzione o nel solvente. Ciò è possibile solo se è presente una barriera semipermeabile, che consente alle molecole di solvente di trasferirla, ma non quelle del soluto, in particolare soluti caricati elettricamente.
Pertanto, il soluto non può essere diffuso da regioni più concentrate a regioni più diluite. Invece, saranno le molecole d'acqua che si sposteranno da un posto all'altro, attraversando la barriera semipermeabile e che si svolgono l'osmosi. Nei sistemi acquosi e biologici questa barriera è per l'eccellenza la membrana cellulare.
Può servirti: competizione (biologia): caratteristiche, tipi, esempiAvere una barriera semipermeabile e un mezzo di solvente, è anche necessaria la presenza di ioni o sali disciolti in entrambi i media: l'interno (all'interno della barriera) e l'esterno (fuori dalla barriera).
Se la concentrazione di questi ioni è la stessa su entrambi i lati, allora non ci sarà eccesso o deficit di molecole d'acqua per risolverli. Cioè, il numero di molecole senza acqua è lo stesso, e quindi non trasferiranno la barriera semipermeabile ovunque con lo scopo di abbinare le concentrazioni degli ioni.
Preparazione
- Condizioni ed equazione
Sebbene una soluzione isotonica possa essere preparata con qualsiasi solvente, poiché l'acqua è il mezzo delle celle, questa è considerata l'opzione preferita. Conoscendo esattamente la concentrazione di sali in un corpo specifico del corpo o nel flusso sanguigno, è possibile stimare la quantità di sali che deve dissolversi in un determinato volume.
Negli organismi vertebrati è accettato che, in media, la concentrazione dei soluti nel plasma nel sangue è di circa 300 mOSM/L (miliosmolarità), essendo in grado di interpretare quasi 300 mmol/L. Cioè, è una concentrazione molto diluita. Per stimare la miliosmolarità, deve essere applicata la seguente equazione:
Osmolarità = m · v · g
Per scopi pratici si presume G, Il coefficiente osmotico ha un valore di 1. In modo che l'equazione sia ora come:
Osmolarità = m · v
Dove M È la molarità del soluto e v Il numero di particelle in cui detto soluto si dissocia nell'acqua. Quindi, moltiplichiamo questo valore per 1.000 per ottenere la miliosmolarità per un particolare soluto.
Può servirti: cos'è l'omoplasia? (Con esempi)Se esiste più di un soluto, la miliorosolarità totale della soluzione sarà la somma delle migliaia di migliaia per ciascun soluto. Più soluto rispetto all'interno delle cellule, meno isotonico sarà la soluzione preparata.
- Esempio di preparazione
Supponiamo che tu voglia preparare un litro di una soluzione isotonica basata sul fosfato di glucosio e di sodio. Quanto dovrebbe essere pesare il glucosio? Supponiamo che vengano usati 15 grammi di nah2Po4.
Primo passo
Dobbiamo prima determinare l'osmolarità nah2Po4 calcolando la sua molarità. Per fare ciò, ci rivolgiamo alla sua massa molare o al peso molecolare, 120 g/mol. Poiché ci viene chiesto un litro di soluzione, determiniamo le talpe e avremo direttamente la molarità:
Talpe (nah2Po4) = 15 g ÷ 120 g/mol
= 0,125 mol
M (nah2Po4) = 0,125 mol/L
Ma quando il nah2Po4 Si dissolve nell'acqua, rilascia un nazione+ e un anione h2Po4-, quindi v Ha un valore di 2 nell'equazione di osmolarità. Procediamo al calcolo quindi per il NAH2Po4:
Osmolarità = m · v
= 0,125 mol/L · 2
= 0,25 OSM/L
E moltiplicandolo per 1.000 abbiamo la miliosmolarità di nah2Po4:
0,25 OSM/L · 1.000 = 250 MOSM/L
Secondo passo
Poiché la miliosolare totale della soluzione deve essere uguale a 300 MOSM/L, sottraggiamo sapere quale dovrebbe essere il glucosio:
MOSM/L (glucosio) = MOSM/L (totale) - MOSM/L (Nah2Po4)
= 300 MOSM/L - 250 MOSM/L
= 50 mosm/l
Perché il glucosio non si dissocia, v Vale 1 e la sua osmolarità sono uguali alla sua molarità:
M (glucosio) = 50 mosm/l ÷ 1.000
= 0,05 mol/L
Essendo il molare del glucosio 180 g/mol, finalmente determiniamo quanti grammi dobbiamo pesare per scioglierlo in quel litro di soluzione isotonica:
Può servirti: Renina: struttura, produzione, secrezione, funzioniMassa (glucosio) = 0,05 mol · 180 g/mol
= 9 g
Pertanto, questa soluzione isotonica NAH2Po4/Il glucosio prepara 15 grammi di nah2Po4 e 9 grammi di glucosio in un litro di acqua.
Esempi di soluzioni isotoniche
Le soluzioni isotoniche o i liquidi non causano gradiente o cambiamenti nella concentrazione di ioni nel corpo, quindi la loro azione si concentra essenzialmente su pazienti idratante che lo ricevono in caso di sanguinamento o disidratazione.
Salino normale
Una di queste soluzioni è la soluzione salina normale, con una concentrazione di NaCl allo 0,9%.
Soluzione lattata suoneria
Altre soluzioni isotoniche utilizzate per lo stesso scopo sono quelle del lattato della suoneria, che riduce l'acidità a causa della sua composizione tampone o smorzante e le soluzioni di fosfato di Sorensen, che sono composte da fosfati e cloruro di sodio.
Sistemi non acquosi
L'isotonicità può anche essere applicata a sistemi non acquosi, come quelli in cui il solvente è un alcol; Finché, c'è una barriera semipermeabile che favorisce la trasparenza delle molecole di alcol e mantiene le particelle di soluto.
Riferimenti
- Da Lehr Spilva, a. E muktans, e. (1999). Guida alle specialità farmaceutiche in Venezuela. Edizione XXXVª. Edizioni globali.
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Elsevier b.V. (2020). Soluzione isotonica. Estratto da: ScienceDirect.com
- Adrienne Brundage. (2020). Soluzione isotonica: definizione ed esempio. Studio. Recuperato da: studio.com
- Felicitas Merino de la Hoz. (S.F.). Seroterapia per via endovenosa. Università di Cantabria. [PDF]. Recuperato da: OCW.Unican.È
- Il laboratorio di farmacia e composizione. (2020). Preparazioni oftalmiche: tamponi isotonici. Recuperato da: Pharmlabs.UNC.Edu

