Struttura di solidi cristallini, proprietà, tipi, esempi

- 4700
- 718
- Lino Lombardi
IL solidi cristallini Sono quelli le cui strutture microscopiche sono ordinate e obbediscono a un modello distintivo per una certa rete cristallina; Ad esempio: cubico, esagonale, triclinico, romboédrica, tra gli altri.
Si dice che questi solidi esistano come cristalli, che mostrano sfaccettature e disegni geometrici che riflettono il modo in cui sono ordinati all'interno. Altri esempi di solidi cristallini sono diamanti, quarzo, antracene, ghiaccio secco, cloruro di potassio o ossido di magnesio.
 Una barra cristallina del crimine. Fonte: Pixabay.
Una barra cristallina del crimine. Fonte: Pixabay. Una coppia di solidi cristallini altamente noti è quello di zucchero e sale (NaCl). A prima vista, entrambi indossano cristalli bianchi; Ma le sue proprietà differiscono molto. Lo zucchero è un solido cristallino molecolare, mentre il sale è un solido cristallino ionico. Il primo è composto da molecole di saccarosio; E il secondo, di na ioni+ e cl-.
L'immagine superiore ti consente di intravedere come possono essere i cristalli di zucchero luminosi. Cristalli di sale, tuttavia non sono molto indietro. Sebbene lo zucchero e il sale abbiano fratelli, le loro strutture sono diverse: lo zucchero, che diventa saccarosio, ha una struttura monoclinica; Mentre sale, una struttura cubica.
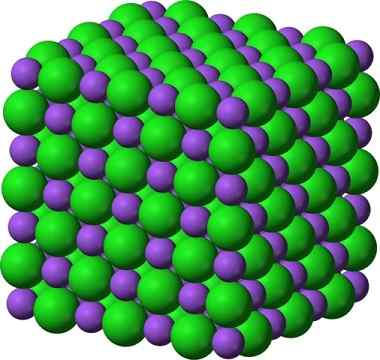 Struttura cristallina di cloruro di sodio, NaCl
Struttura cristallina di cloruro di sodio, NaCl Lo zucchero e il sale spruzzato (GLA) rimangono cristallini; I suoi cristalli sono diventati solo molto più piccoli per i nostri occhi. La cristallinità di un solido, quindi, è definita più dalla sua struttura interna, che dal suo aspetto esterno o dai suoi luccichio.
[TOC]
Struttura dei solidi cristallini
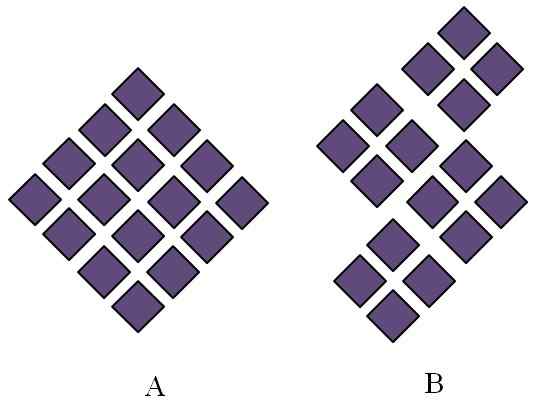 Strutture ordinate di solidi cristallini. Fonte: Gabriel Bolívar.
Strutture ordinate di solidi cristallini. Fonte: Gabriel Bolívar. I solidi cristallini hanno ordinato strutture. Le sue caratteristiche geometriche dipenderanno dal tipo di rete cristallina a cui appartengono, che a sua volta viene proiettata esternamente nelle forme del cristallo (sistema cristallino). L'immagine superiore illustra due importanti concetti di tali strutture: periodicità e cereali cristallini.
Può servirti: fase di dispersioneIl sistema spaziale delle particelle di un solido cristallino è il giornale; Cioè, viene ripetuto ancora e ancora in tutte le direzioni. Ciò provoca il proprio modello strutturale per ogni rete solida e cristallina; Ad esempio, è qui che sale e zucchero iniziano a differenziarsi oltre la sua natura chimica.
Nei rombi viene ordinato di dare origine a un rombo di proporzioni maggiori. Ogni rombo viola rappresenta una particella o un insieme (atomi, ioni o molecole). Pertanto, ci si potrebbe aspettare che un cristallo macroscopico di A abbia un aspetto romboédica.
Nel frattempo, in B i rombi sono ordinati in modo tale da originare i cereali cristallini; Questi sono cristalli molto piccoli (cristalliti). Si dice quindi che B è un solido poliristale; cioè, è formato dall'agglomerato multiplo cristalliti.
In conclusione, un solido può essere semplicemente cristallino (A) o poliristalina (B); Nella forma dei cristalli, mentre B Poliristales.
Proprietà
Le proprietà dei solidi cristallini dipendono dal suo tipo di vetro. È noto che le loro strutture sono ordinate e che di solito presentano anche brillanti fazioni che si innamorano degli amanti dei minerali. Tuttavia, è stato fatto menzione che un solido polveroso, incluso "off", può anche essere classificato come cristallino.
Il modo in cui le loro particelle sono orientate spazialmente consente loro di avere alcune proprietà importanti per la loro caratterizzazione. Ad esempio, i solidi cristallini sono in grado di diffrattare raggi X, creando spettri di diffrazione da cui è possibile determinare la struttura microscopica di un cristallo.
Allo stesso modo, poiché la struttura è periodica, il calore viene diffuso allo stesso modo in tutto il solido; Finché non ci sono impurità nel mezzo. Pertanto, i punti di fusione per un solido cristallino sono costanti e non variano indipendentemente da come vengono misurati.
Può servirti: gallio: proprietà, struttura, ottenimento, usiTipi di solidi cristallini
I tipi di solidi cristallini si basano su quale tipo di particelle lo compongono e quali sono le loro interazioni o collegamenti. Esistono quattro tipi: reti ioniche, metalliche, molecolari e covalenti.
Anche quando presentano un certo grado di impurità, continuano ad essere cristallini, sebbene le loro proprietà siano interessate e non mostrano gli stessi valori previsti per un solido puro.
Ionico
Il sale è un esempio di solido cristallino ionico, in quanto è composto da ioni Na+ e cl-. Pertanto, in questo tipo di solidi il legame ionico: sono le forze elettrostatiche che regolano l'ordine strutturale.
Metallo
Tutti gli atomi di metallo formano cristalli metallici. Ciò significa che, ad esempio, una forcella d'argento è un conglomerato di cristalli d'argento fusi. La struttura interna o microscopica è la stessa in ogni palmo dell'oggetto e rimane invariata dalla maniglia della forchetta alla punta dei denti.
Molecolare
Lo zucchero è un esempio di solido cristallino molecolare, in quanto è formato da molecole di saccarosio. Pertanto, questo tipo di solido è costituito da molecole, che attraverso le sue interazioni intermolecolari (e legami non covalenti) riescono a stabilire una struttura ordinata.
Reti covalenti
Infine, abbiamo i solidi cristallini di reti covalenti. Predominano i legami covalenti, poiché sono responsabili di stabilire un ordine e mantenere gli atomi fortemente fissati nelle rispettive posizioni spaziali. Non si parla di ioni, atomi o molecole, ma di reti tridimensionali.
Esempi
Successivamente, e infine, alcuni esempi saranno citati per ciascuno dei tipi di solidi cristallini.
Può servirti: elettronegativitàIonico
Tutti i sali sono solidi ionici. Ci sono anche solfuri, idrossidi, ossidi, alogeni e altri composti che sono anche formati dagli ioni o le loro interazioni sono in essenza ionica. Abbiamo:
-Kcl
-Caso4
-Ba (oh)2
-Cuso4
-Fecl3
-N / a2S
-MgO
-CAF2
-Nahco3
-(NH4)2CRO4
Oltre a questi esempi, la stragrande maggioranza dei minerali sono considerati solidi cristallini ionici.
Metallo
Qualsiasi elemento metallico è naturalmente presentato come cristalli di metallo. Alcuni di loro sono:
-Rame
-Ferro
-Alluminio
-Cromo
-Idrogeno metallico (sotto pressioni inimmaginabili)
-Tungsteno
-Zirconio
-Titanio
-Magnesio
-Sodio
Molecolare
Esistono un'ampia varietà di solidi cristallini molecolari. Praticamente qualsiasi composto organico che solidifica riesce a stabilire cristalli se la sua purezza è elevata o se la sua struttura non è troppo complessa. Quindi abbiamo:
-Ghiaccio (h2O)
-Ghiaccio secco (CO2)
-Yo2
-P4
-S8 (e i suoi polimorfi)
-Antracene
-Ossigeno solido
-Ammoniaca solida
-Fenolftaleina
-Acido benzoico
Reti covalenti
E infine, tra alcuni solidi cristallini di reti covalenti che abbiamo:
-Diamante
-Grafite
-Nanotubi di carbonio
-Fullerenos
-Quarzo
-Silicio
-Germanio
-Nitruro di boro
Da questo elenco, i nanotubi di carbonio e il fullerene potrebbero anche essere considerati solidi cristallini molecolari. Questo perché, sebbene siano costituiti da atomi di carboni uniti covalentemente, definiscono unità che possono essere visualizzate come macromolecole (palloni da calcio e tubi).
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2020). Cristallo. Recuperato da: in.Wikipedia.org
- Chimica librettexts. (16 giugno 2019). Solidi cristallini e amorfi. Recuperato da: Chem.Librettexts.org
- Rachel Bernstein e Anthony Carpi. (2020). Proprietà dei solidi. Recuperato da: Visionlearning.com
- « Struttura di solidi amorfi, proprietà, esempi
- Cause di esplosione demografica, conseguenze, vantaggi, svantaggi »

