Struttura di solidi amorfi, proprietà, esempi

- 1404
- 212
- Dott. Rodolfo Gatti
IL solidi amorfi Sono quelli che non hanno una struttura a lungo termine ordinata. Sono l'opposto di ciò che è noto da un solido cristallino. Le loro particelle sono associate in modo disordinato, simili a quelle dei liquidi, ma con una forza sufficiente per la coesione in una struttura solida.
Questo carattere amorfo è più comune di quanto si possa pensare; È in effetti uno dei possibili stati che la questione condensata può adottare. Ciò comprende che qualsiasi composto in grado di consolidarsi e, quindi, cristallizzante, può anche essere attaccato in modo disordinato se le condizioni sperimentali lo consentono.
 Cotton of Sugar è un esempio di un solido amorfo. Fonte: Pixabay.
Cotton of Sugar è un esempio di un solido amorfo. Fonte: Pixabay. Quanto sopra viene solitamente applicato a sostanze pure, sia elementi che composti. Ma è anche valido nel caso delle miscele. Molte miscele solide sono amorfe, come con il cotone di zucchero, cioccolato, maionese o purea di patate.
Quello che un solido è amorfo non lo rende meno prezioso di un cristallino. Il disturbo strutturale a volte gli dà proprietà uniche che non presenterebbero in condizioni cristalline. Ad esempio, il silicio amorfo è preferito nell'industria fotovoltaica prima dell'obiettivo per alcune applicazioni di piccola scala.
[TOC]
Struttura dei solidi amorfi
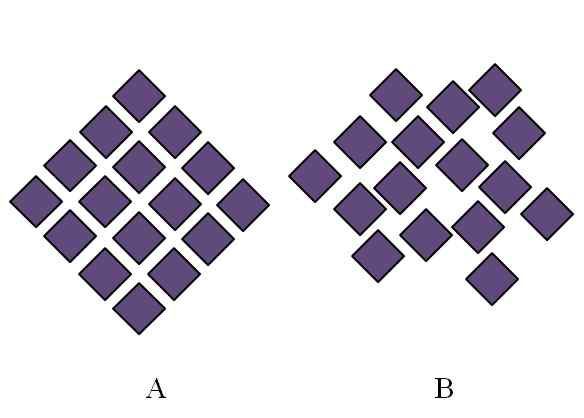 Differenza tra una struttura cristallina e una struttura amorfa. Fonte: Gabriel Bolívar.
Differenza tra una struttura cristallina e una struttura amorfa. Fonte: Gabriel Bolívar. La struttura di un solido amorfo è disordinata; Manca la periodicità o un modello strutturale. L'immagine superiore illustra questo punto. Corrisponde a un solido cristallino, mentre B rappresenta un solido amorfo. Si noti che nei rombi viola b sono disposti arbitrariamente, anche quando sia in e b, ci sono lo stesso tipo di interazioni.
Può servirti: fenolphthalein (C20H14O4)Se si vede anche B, si vedrà che ci sono spazi che sembrano essere vuoti; Cioè, la struttura presenta difetti o irregolarità. Pertanto, parte del disturbo microscopico o interno di un solido amorfo è dovuta al fatto che le sue particelle "si adattano" in modo tale che la struttura risultante abbia molte imperfezioni.
Inizialmente, l'ambito è stato fatto nel grado di ordinazione di solidi amorfi. In b non ci sono quasi un paio di rombi che sembrano allineati in ordine. Potrebbero esserci regioni ordinate; Ma solo a breve distanza.
Si dice quindi che un solido amorfo sia realizzato in cristalli imminenti piccoli di strutture diverse. La somma di tutte queste strutture finisce per labirintina e insignificante: la struttura globale diventa amorfa, composta da una serie di blocchi cristallini sparsi ovunque.
Proprietà
Le proprietà di un solido amorfo variano a seconda della natura delle sue particelle conformi. Tuttavia, ci sono alcune caratteristiche generali che possono essere menzionate. I solidi amorfi possono essere vitrei, quando hanno aspetti simili ai cristalli; o gelatino, resinoso o polveroso.
Essere le loro strutture disordinate non generano spettri di diffrazione di raggi X affidabili. Inoltre, i suoi punti di fusione non sono precisi, ma coprono un intervallo di valori.
Ad esempio, il punto di fusione per un solido amorfo può variare da 20 a 60 ºC. Nel frattempo, i solidi cristallini si sciolgono a una temperatura specifica o in un intervallo stretto se contengono molte impurità.
Un'altra caratteristica dei solidi amorfi è che quando si rompono o frattura, non causano facce geometriche e piatte, ma frammenti irregolari con facce curve. Quando non sono vitreo, sono presentati come corpi polverosi e opachi.
Può servirti: Alilo: unità allyica, carbocalizzazione, radicale, esempiPreparazione
Più di un solido amorfo, è conveniente affrontare questo concetto come uno "stato amorfo". Tutti i composti (ionici, molecolari, polimerici, metallici, ecc.) Sono capaci, in una certa misura e se le condizioni sperimentali lo consentono, di formare solidi amorfi e non cristallini.
Ad esempio, nella sintesi organica i composti solidi all'inizio sono ottenuti come masse polverose. Il suo contenuto di impurità è così elevato che influisce sul suo ordine molecolare a lungo raggio. Questo è il motivo per cui quando il prodotto viene ricryposto ancora e ancora, il solido diventa sempre più cristallino; sta perdendo il suo carattere amorfo.
Ciò non significa che i solidi amorfi siano necessariamente materiali impuri; Molti di loro sono amorfi per la propria natura chimica.
Una sostanza pura può consolidarsi amorficamente se il tuo liquido si raffredda bruscamente, in modo che le loro particelle non si cristallizzano, ma adottano una configurazione vitreo. Il raffreddamento è così veloce che le particelle non hanno abbastanza tempo per accogliere i blocchi cristallini che sono appena "nati".
L'acqua, ad esempio, è in grado di esistere in uno stato vitreo, amorfo e non solo come il ghiaccio.
Esempi di solidi amorfi
Minerali e plastica
 Obsidian è uno dei pochi minerali amorfi che sono conosciuti. Fonte: Pixabay.
Obsidian è uno dei pochi minerali amorfi che sono conosciuti. Fonte: Pixabay. Praticamente qualsiasi materiale cristallino può adattarsi a una forma amorfa (e viceversa). Ciò accade con alcuni minerali, che per ragioni geochimiche non potevano formalmente stabilire i loro cristalli convenzionali. Altri, d'altra parte, non formano cristalli ma vetro; Questo è il caso di Obsidian.
D'altra parte, i polimeri tendono a solidificarsi amorfici, poiché le loro molecole sono troppo grandi per definire una struttura ordinata. Ecco resine, gomme, schiuma di polistirolo (anime), materie plastiche, teflon, baquelita, tra gli altri.
Può servirti: esteriTessuto biologico
I solidi biologici sono per lo più amorfi, come: tessuto di organi, pelle, capelli, cornea, ecc. Inoltre, grassi e proteine formano masse amorfe; Tuttavia, con un'adeguata preparazione, possono cristallizzazione (cristalli di DNA, proteine, grassi).
Bicchiere
 Vetro, un solido amorfo
Vetro, un solido amorfo Sebbene quasi ultimo, il solido amorfo più rappresentativo è, di gran lunga il vetro stesso. La sua composizione in sostanza è uguale a quella del quarzo: SIO2. Sia il cristallo e il vetro di quarzo sono reti covalenti tridimensionali; Solo la rete di vetro è disordinata, con collegamenti si-o di diverse lunghezze.
 Campione di vetro metallico
Campione di vetro metallico Il vetro è il solido amorfo per eccellenza e si dice che i materiali che acquisiscono un aspetto simile abbiano uno stato vitreo.
Carbon e metalli
Abbiamo carbonio amorfo, essendo il carbonio attivato da una delle sue capacità assorbenti. C'è anche silicio e Germania amorfo, con applicazioni elettroniche in cui agiscono come semiconduttori.
E infine, ci sono leghe amorfe, che a causa della disparità dei loro atomi di metallo conformi non stabiliscono una struttura cristallina.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Rachel Bernstein e Anthony Carpi. (2020). Proprietà dei solidi. Recuperato da: Visionlearning.com
- Wikipedia. (2020). Solido amorfo. Recuperato da: in.Wikipedia.org
- Richard Zallen, Ronald Walter Douglas e altri. (31 luglio 2019). Solido amorfo. Encyclopædia Britannica. Recuperato da: Britannica.com
- Elsevier b.V. (2020). Solido amorfo. Scienceirect. Estratto da: ScienceDirect.com
- Danielle Reid. (2020). Solido amorfo: definizione ed esempio. Studio. Recuperato da: studio.com
- Opere d'arte del cubo di Rubik. (2008). Cos'è un materiale amorfo? Estratto da: web.Fisica.Ucsb.Edu
- « Concetto di ruolo sociale secondo Talcott Parsons, tipi ed esempi
- Struttura di solidi cristallini, proprietà, tipi, esempi »

