Proprietà di vendita alide, nomenclatura, come si formano, esempi

- 1710
- 251
- Enzo De Angelis
IL sali alidi Sono composti binari formati da un metallo e un non metal, senza nessun altro elemento. Questi sali sono formati dalla reazione di neutralizzazione tra un acido idrazia con una base. Ad esempio: la reazione tra acido cloridrico (HCl) con idrossido di sodio (NaOH) per formare cloruro di sodio (NaCl).
I sali aloidali sono anche formati dalla reazione di un'idrazia con un metallo. Ad esempio: la reazione di magnesio con acido cloridrico per formare cloruro di magnesio (MGCL2). Come visto, i cloruri sono i sali alidi più rappresentativi. Tuttavia, non sono gli unici.
 Halita, cloruro di sodio nel suo stato naturale, è l'esempio principale di un sale alideo. Fonte: http: // gl.Wikipedia.org/w/indice.PHP?Titolo = Utente: Shinichi / Public Domain
Halita, cloruro di sodio nel suo stato naturale, è l'esempio principale di un sale alideo. Fonte: http: // gl.Wikipedia.org/w/indice.PHP?Titolo = Utente: Shinichi / Public Domain I sali alidi, secondo alcune definizioni, comprendono i composti che contengono nella loro struttura alogena; Cioè: fluoro, cloro, bromo e iodio, quindi sono considerati sinonimi di alogenuri o alogenuri.
Allo stesso modo, all'interno dei sali alidi sono inclusi, da alcuni autori, composti formati dall'unione di un metallo con un elemento che sta usando la sua valenza negativa, tra cui: carburi, nitruri, fosfuri, solfuri, seleniuros, arseniuros, ecc. Questi contano anche come sali alidi ogni volta che consistono solo in due elementi.
[TOC]
Proprietà di vendita alide
I sali alidi sono un gruppo di composti le cui proprietà sono difficili da stabilire.
Forti legami ionici
In generale, sono costituiti da solidi con forti legami ionici tra ioni di due elementi: M+X-, dove m+ corrisponde al catione metallico e x- l'anione derivato da non metal.
Punti di fusione elevati, ebollizione e sublimazione
Di solito hanno punti di fusione, ebollizione e sublimazione molto elevati, a causa precisamente alla forza della sua struttura cristallina.
Può servirti: DAPI (4 ', 6-diamidino-2-fenilindolo): caratteristiche, fondazione, usoConduzione dell'elettricità
In solido stato sono cattivi conduttori di elettricità, ma in soluzione acquosa quando ionizzano o quando si fondono, i buoni driver diventano.
Aspetto
Sono solidi cristallini che quando frammentati in polvere possono diventare una colorazione bianca. Tuttavia, molti sali alidi possono avere una colorazione diversa. Ad esempio, il cloruro di nichel è verde, mentre il cloruro ferrico ha una colorazione oscillante tra verde e rosso.
Solubilità
La maggior parte dei sali di Haluros è solubile in acqua, ad eccezione dell'argento, del piombo (II) e degli alogenuri di mercurio (I).
Odore
Poiché non sono composti volatili, i sali alidi non presentano odori forti. Inoltre, a causa della loro composizione possono essere sapori aspri, salati, amari o dolci.
Nomenclatura
I sali alidi sono nominati posizionando il nome dell'anione con il suffisso aurochs, seguito direttamente dal nome del metallo, preceduto dalla congiunzione Di. Nel caso in cui il metallo abbia più di una valenza, il metallo viene posizionato con il suffisso orso o ICO, A seconda della sua Valencia.
Il nome del metallo può anche essere posizionato senza suffisso e con il numero di ossidazione tra parentesi.
Ad esempio: cloruro di ferro (III) o cloruro ferrico, FECL3.
Come si formano i sali alidi?
I sali alidi sono formati principalmente da tre reazioni: neutralizzazione, reazione acida con un metallo e la reazione di un metallo con un metallo o una recitazione non metallica con una valenza negativa.
Reazione di neutralizzazione
È la reazione di un acido con una base, producendo sale e una molecola d'acqua. Per esempio:
HCl +NaOH → NaCl +H2O
Questo esempio è stato menzionato al principe.
Reazione di un acido con un metallo
Un acido forte può reagire con un metallo, originario di un sale e il rilascio di idrogeno (H2). Ad esempio: l'acido cloridrico reagisce con lo zinco (Zn) per formare cloruro di zinco (ZnCl2)
Può servirti: chimica analiticaZn +HCl → ZnCl2 + H2
Combinazione di un metallo con un metallo o un non metal
Questi sali alidi derivano dalla combinazione di un metallo con un metallo o un non metal di alogeni. Ad esempio: l'alluminio fosfuro combina fosforo con Valencia -3, con alluminio con valencia +3. Ora, questa "combinazione" è dovuta a reazioni di produzione specifiche per ogni sale.
Usi/applicazioni
Halogenuros metallico
Halogenuros metallico sono usati in lampade ad alta intensità, come le lampade moderne. Sono anche usati nelle serre o nei climi di pioggia per integrare la luce naturale. Gli alogenuri d'argento sono usati nei film e nelle carte fotografiche.
Cloruro di calcio
 Aspetto del cloruro di calcio
Aspetto del cloruro di calcio Il cloruro di calcio viene utilizzato come fonte di calcio nel trattamento delle acque reflue. Viene anche usato come fonte di calcio attraverso la sua elettrolisi. È usato nel trattamento delle aritmie cardiache e in caso di grave ipocalcemia.
Cloruro ferrico
Il cloruro ferrico viene utilizzato nel trattamento delle acque reflue e nella purificazione dell'acqua. Viene anche utilizzato per registrare o optare per il rame e intervenire come catalizzatore nel processo di sintesi del cloruro di vinile.
Bromuro di cloruro e potassio
Il cloruro di potassio è usato come fertilizzante e nel trattamento dell'iponokalemia o dell'ipero. Il bromuro di potassio, d'altra parte, è stato usato come anticonvulsivo ed è attualmente utilizzato nell'industria farmaceutica e come una medicazione.
Cloruro e solfuro di sodio
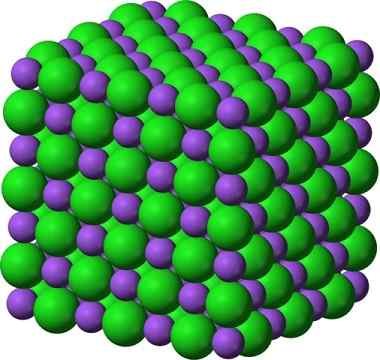
 La struttura cristallina del cloruro di sodio, NaCl, un tipico composto ionico. Le sfere __ viola rappresentano cationi di sodio, Na +e __ Le sfere verdi rappresentano il cloruro degli anchi, cl−.
La struttura cristallina del cloruro di sodio, NaCl, un tipico composto ionico. Le sfere __ viola rappresentano cationi di sodio, Na +e __ Le sfere verdi rappresentano il cloruro degli anchi, cl−. Il cloruro di sodio viene usato come sapore alimentare, nella conservazione della carne, come antisettico, in grave iponatriemia, ecc. Il solfuro di sodio viene utilizzato nei reattori nucleari nella produzione di acqua pesante, nell'eliminazione dei peli delle pelli e nella produzione di gomme, coloranti e dipinti.
Può servirti: ossido di alluminio: struttura, proprietà, usi, nomenclaturaPhosfuros e Nituros
Il fosfuro di alluminio è usato come semiconduttore a banda e come insetticida. Nel frattempo, il nitruro di gallio viene usato come semiconduttore.
Esempi di sali alidi
Oltre agli esempi menzionati nella sezione precedente, altri sali alidi con le rispettive formule e nomi:
-NaCl: cloruro di sodio
-KCL: cloruro di potassio
-Cacl2: Cloruro di calcio
-MGCL2: Cloruro di magnesio
-CSCL: cloruro di cesio
-Bacl2: Cloruro di bario
-Fecl2: Cloruro ferroso
-Fecl3: Cloruro ferrico
-Nicl2: Cloro di nichel
-Cucl: cloruro cuproso
-Cucl2: Cloruro cupric
-AGCL: cloruro d'argento
-Zncl2: Cloruro di zinco
-CDCL2: Cloruro di cadmio
-Hgcl2: Cloruro mercurico
-Alcl3: Cloruro di alluminio
-Nabr: bromuro di sodio
-KBR: bromuro di potassio
-CSBR: bromuro di cesio
-CDBR: bromuro di cadmio
-Mgbr2: Bromuro di magnesio
-Srbr2: Bromuro di stronzio (II)
-Ki: Yoduro di potassio
-Nai: ioduro di sodio
-CSI: Cesio Yoduro
-Ali3: Ioduro in alluminio
-PIL2: Ioduro di piombo (ii)
-NAF: fluoruro di sodio
-LIF: fluoruro di litio
-CAF2: Fluoruro di calcio
-Ptf2: Fluoruro di platino (II)
-Nas2: Solfuro di sodio
-Li4C: carburo di litio
-Mg2C: Carburo di magnesio
-ALP: fosfuro in alluminio
-Sì3N4: Silicio nitruro
-Stagno: nitruro in titanio
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (quarta edizione). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Julián Pérez Porto e María Merino. (2016). Definizione di sali alidi. Definizione.Di. Recuperato da: Definizione.Di
- James P. Birk. (5 giugno 2019). Alogenuri. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- Wikipedia. (2020). Alogenuro. Recuperato da: in.Wikipedia.org
- « Proprietà dei perossidi, nomenclatura, usi, esempi
- Caratteristiche, funzioni, parti, usi del termoigometro »

