Proprietà dei perossidi, nomenclatura, usi, esempi
- 997
- 42
- Cosetta Messina
IL perossidi Sono tutti quei composti chimici che contengono il gruppo peroxo, O-O, collegati covalentemente ad atomi di carbonio o altri gruppi funzionali, o in forma ionica come l'anione del perossido, o22-. Quanto sopra è rappresentato graficamente nell'immagine qui sotto. In esso il gruppo O-O si distingue con un colore blu.
Potrebbero esserci perossidi organici come i diaquilperossidi (R1-O-o-r2), Idroperossidi (R-O-O-H), peracidi (RCO-O-O-O-H) e Peéstres (R1Coo-o-o-r2). Abbiamo anche perossidi inorganici, come i perossidi metallici (MN+O22-) e perossido di idrogeno (H-O-H). Quest'ultimo è il più noto di tutti, riceve il nome di perossido di idrogeno.
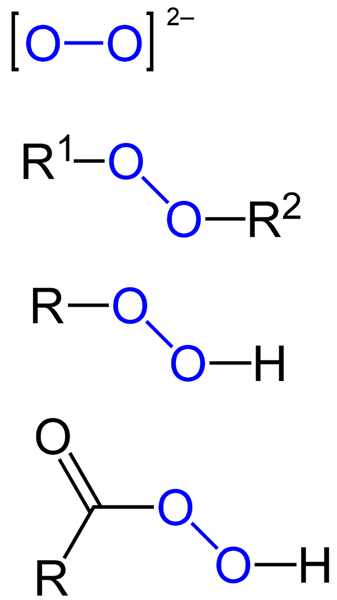 Formule per diversi tipi di perossidi esistenti. Fonte: Jü / pubblico dominio
Formule per diversi tipi di perossidi esistenti. Fonte: Jü / pubblico dominio Tutti i perossidi condividono in comune la proprietà di essere sostanze molto reattive e ossidanti e, in alcuni casi, esplosivi. A meno che non siano specificati sintetizzandoli, sono considerati impurità indesiderate e pericolose per molti processi industriali e per la sintesi di laboratorio.
I perossidi in generale sono eccellenti agenti ossidanti, sbiancamento, battericidi e attivatori delle polimerizzazioni attraverso la formazione di radicali liberi. Ecco perché di solito sono reagenti o additivi molto utili nell'industria dei polimeri, nonché nell'industria alimentare per accelerare le ossidazioni ed eliminare i batteri.
[TOC]
Proprietà del perossido
Struttura
Le strutture di perossido si concentrano sul gruppo O-O. Ogni atomo di ossigeno ha un'ibridazione SP3, Quindi i collegamenti -o -do non riposano nello stesso piano. Ad esempio, per il perossido di idrogeno, H-O-H, l'angolo formato tra le due h è 115.5 °, che mostra che i quattro atomi non sono su un piano.
Le distorsioni di questo e di altri angoli dipenderanno dall'identità degli altri frammenti molecolari legati al gruppo O-O.
Può servirti: Gibbs Free Energy: unità, come viene calcolato e risolti eserciziD'altra parte, i perossidi organici e inorganici (ad eccezione del metallico) possono essere riconosciuti ad occhio nudo se il gruppo O-O è dettagliato nella loro struttura, come due occhiali con una "bocca". In questo modo, qualsiasi perossido viene immediatamente identificato con una singola vista della sua struttura.
Reattività
Il collegamento O-O è relativamente debole rispetto ad altri collegamenti come C-H o C-O. Ecco perché tende a rompersi o frammenti per produrre radicali ossigenati altamente reattivi.
Sono a causa di questi radicali che i perossidi sono classificati come sostanze reattive e pericolose, poiché possono danneggiare i tessuti e qualsiasi materia organica in generale.
Azione ossidante
I perossidi sono potenti agenti ossidanti, che cercano di guadagnare elettroni dall'ambiente per trasformarsi in acqua, ossigeno o idrossidi. Ad esempio, il perossido di idrogeno è un agente ossidante più forte dello stesso permanganato di potassio.
Questa azione ossidante viene utilizzata per rilevarli attraverso la loro reazione con solfato ferroso e tiocianato di potassio:
Perossido +fede2+ + Scn- → Fe (SCN)N(3-N)- (N = 1 a 6).
Il complesso formato tra la fede3+ e lo SCN- È rosso sangue, quindi l'osservazione di questo colore corrisponde a un test positivo per la presenza di perossidi nel campione.
Sensibilità
I perossidi sono sostanze sensibili alle alte temperature e alla luce solare. Pertanto, devono essere conservati in siti sicuri e all'interno di contenitori di plastica e opaco, in modo che la luce non li influenzi direttamente.
Nomenclatura
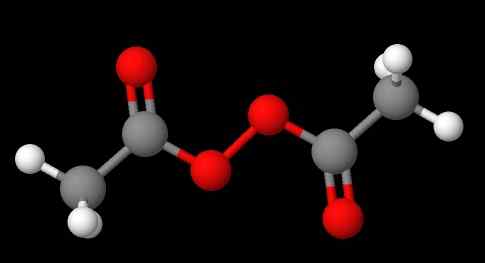
La nomenclatura dei perossidi dipende da quale tipo appartengono. In generale, molti sono nominati menzionando "perossido di" seguito dai sostituenti R in ordine alfabetico. Ad esempio, composto CH3C (o) ooc (o) ch3 (l'immagine inferiore) è chiamata perossido di diacetil o acetil.
Può servirti: solfato di sodio (Na2SO4): struttura, proprietà, usi, ottenimento Perossido di diacetil. Fonte: Gabriel Bolívar via Molview.
Perossido di diacetil. Fonte: Gabriel Bolívar via Molview. Il composto c6H5C (o) ooc (o) c6H5 (Immagine inferiore), d'altra parte, si chiama dibenzoílo o perossido di benzoílo, per le stesse ragioni dichiarate nel paragrafo precedente.
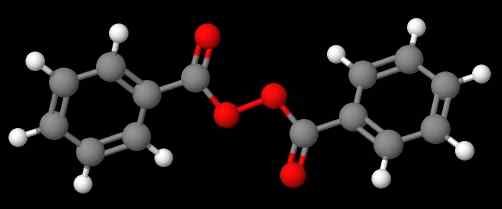 Perossido di benzoile. Fonte: Gabriel Bolívar via Molview.
Perossido di benzoile. Fonte: Gabriel Bolívar via Molview. Nel frattempo, composto C6H5C (o) ooc (o) ch3 è chiamato perossido di acetil benzolelo. Questa volta il sostituente acetile è menzionato per primo per iniziare con la lettera "A". Un altro esempio è Ch3Cap2OOC6H5, Chiamato perossido di etil fenil.
Allo stesso modo, procedi con idroperossidi. Ad esempio, Cho3OOH è chiamato metil idroperossido.
Formazione
Alcuni perossidi possono essere formati direttamente dall'esposizione della sostanza in questione con l'ossigeno dell'aria, assistito o meno con catalizzatori metallici. Possono anche formarsi esponendo la sostanza all'ozono in determinate condizioni, eseguendo la reazione di ozonolisi.
Un altro percorso sintetico è reagire il perossido di idrogeno con un alchyporsulfato:
R2SW4 + H2O2 → R-O-R +H2SW4
Al fine di sintetizzare o formare perossidi diachilici o persino perossidi ciclici.
Nel frattempo, molti dei metodi per formare perossidi metallici si basano sull'ossigenazione dei rispettivi ossidi metallici, in modo che "ossigeno" e vanno dall'essere MO (MN+O2-) Amore2 (MN+O22-).
Perossidi usa
Iniziatori di polimerizzazioni
I perossidi, in particolare i perossidi organici, vengono aggiunti ai mezzi di reazione per la sintesi di infinito di materiali e materiali come polistirene, silicone, resine epossidiche e acriliche, cloruro di polivinile, fibra di vetro, tra altri.
Questo perché soffrono di decomposizioni termiche per diventare radicali liberi ossigenati, che a loro volta scatenano e catalizzano le polimerizzazioni. Pertanto, sono desiderabili nel settore dei polimeri.
Può servirti: frazione molare: come viene calcolato, esempi, eserciziAlcuni dei perossidi usati come iniziatori sono il perossido di metil cetona (MEK) e perossido di acetone.
Candeggina e disinfettanti
I perossidi sono agenti sbiancanti, usati per sbiancare carta e polpa di farina. Sono anche agenti disinfettanti, totalmente efficaci ma aggressivi in termini di sterminio dei batteri. L'esempio classico corrisponde al perossido di idrogeno, destinato a soluzioni diluite (3%) per disinfettare le ferite.
Agenti ossidanti
I perossidi sono anche agenti ossidanti, quindi trovano molti usi nella sintesi organica di sostanze molto ossigenate.
Fonti di ossigeno
Sebbene non sia tra i suoi usi principali, i perossidi possono anche fungere da fonti di ossigeno in alcuni dei loro guasti. Questo è il caso, di nuovo, del perossido di idrogeno.
Esempi di perossidi
Infine, saranno elencati alcuni esempi di perossidi, sia organici che inorganici, con le loro formule e i rispettivi nomi:
-H2O2: Perossido di idrogeno o idrogeno
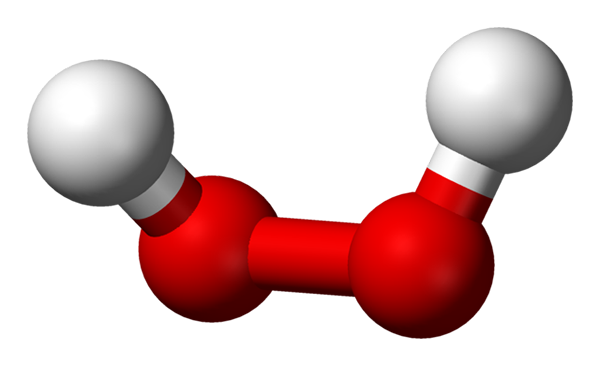 Molecola di perossido di idrogeno rappresentato con un modello di sfere e barre. Fonte: Benjah-BMM27 via Wikipedia.
Molecola di perossido di idrogeno rappresentato con un modello di sfere e barre. Fonte: Benjah-BMM27 via Wikipedia. -N / a2O2: perossido di sodio
-Trave2: perossido di bario
-C6H5C (Ch3)2OOH: cumeno idroperossido
-(NH4)2S2O8: Persolfato di ammonio
- Ho3Sooso3H: acido perossidisulfurico
-(Ch3)3COOC (Ch3)3: Perossido di-butil-butil
Riferimenti
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. (10th Edizione.). Wiley Plus.
- Carey f. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2020). Perossido organico. Recuperato da: in.Wikipedia.org
- Elsevier b.V. (2020). Perossido. Scienceirect. Estratto da: ScienceDirect.com
- Sviluppo di chimica avanzata. (S.F.). Alcoli, fenoli e loro derivano:
- Regola di perossidi C-218. Recuperato da: ACDLABS.com
- Vol'nov i.Yo., Petrocelli a.W. (1966) Classificazione e nomenclatura dei composti di perossido inorganico. In: Petrocelli a.W. (A cura di) Perossidi, Superossidi e Ozonidi di metalli di terra alcali e alcalina. Springer, Boston, MA.
- « La tipica Baja California Sur per uomini e donne (descrizione)
- Proprietà di vendita alide, nomenclatura, come si formano, esempi »

