Formula di sali di base, proprietà, nomenclatura, esempi

- 2295
- 298
- Lino Lombardi
IL sali di base Sono tutti quelli che si dissolvono nell'acqua generano soluzioni con valori di pH superiori a 7. Questo è spiegato dalla formazione di ioni oh-, che provengono direttamente dal processo di dissoluzione o dall'equilibrio dell'idrolisi in cui partecipa l'anione.
I sali di base contengono anione oh- Nei loro solidi. Ad esempio, gli idrossidi alcalini, come sodio e potassio, Naoh e Koh, sono considerati membri di questi sali; Sebbene siano estremamente caustici, motivo per cui meritano la denominazione degli idrossidi invece di essere chiamati sali.
 L'idrossido di sodio è un esempio di sale di base
L'idrossido di sodio è un esempio di sale di base Altri sali di base hanno invece anioni come il carbonato, CO32-. Il carbonato deriva dall'acido carbonico, h2Co3, Un acido debole. Pertanto, i sali di carbonato, come il carbonato di calcio utilizzato negli antiacidi, sono classificati come sali di base. Lo stesso ragionamento si applica al bicarbonato di sodio, Nahco3, E per tutti gli altri sali di bicarbonato.
I sali di base sono importanti perché molti di essi aiutano a neutralizzare l'acidità alimentare. Possono anche essere usati per preparare soluzioni di smorzamento al pH alcalino.
[TOC]
Definizioni
I sali di base hanno due definizioni che si completano a vicenda: contengono oh anioni- Nei loro solidi o generano questi stessi anioni idrossilli una volta che i loro cristalli si dissolvono in acqua.
Indipendentemente dalla definizione scelta, il pH delle sue soluzioni acquose sarà maggiore di 7 e, pertanto, saranno alcalini o di base.
Formula generale dei sali di base
Chiarito ciò che viene compreso dal sale di base, la sua formula, sebbene non strettamente generale, è la seguente:
MN(OH)WXov
Dove m è il catione metallico o di ammonio, oh gli idrossili e xo l'anione derivato da un acido debole o forte. Gli abbonamenti N, W E v Quanti m, oh e xo, rispettivamente, costituiscono il sale di base, nonché le loro proporzioni.
Notare che v Può essere uguale a zero, il che significa che abbiamo un idrossido di alcalino o alcalinotrereo. Questo è ciò che accade con Naoh e Koh. Allo stesso modo, W Può essere zero, il che significa che non ci sono ioni oh-. Ad esempio, il Caco3 Non ha oh-, Eppure rimane un sale di base.
Può servirti: solfuro di calcio (CAS): struttura, proprietà, ottenimento, usiDa quanto sopra si conclude che la formula generale dei sali di base è mN(OH)WXov, Ma non tutti i sali sono conformi a questo. Pertanto, un fattore più importante da tenere in considerazione è la natura dell'anione xo. Pertanto, sarà noto quando un sale è di base, indipendentemente dal fatto che abbia ioni oh- Nelle loro formule.
Proprietà dei sali di base
I sali di base si dissolvono in acqua seguendo la seguente equazione:
MN(OH)WXov(s) → NM+(AC) + WOH-(AC) + vXo-(AC)
Si noti che quando si dissolve rilascia ioni oh- in acqua. Ciò influisce sul pH della soluzione, diventando alcalino con un valore superiore a 7. Ad esempio, il nitrato di calcio di base si dissolve nell'acqua in base a come segue:
Ca (oh) no3(s) → Ca2+(AC) + OH-(AC) + NO3-(AC)
I valori di N, W E v Sono uguali a 1 per questo sale.
D'altra parte, i sali di base che non hanno oh-, Ma un anione derivato da un acido debole viene idrolizzato nell'acqua:
Ladro3(s) → Ca2+(AC) + CO32-(AC)
Co32-(AC) + H2O (l) ⇌ HCO3-(AC) + OH-(AC)
Si noti che il prodotto di questa idrolisi è un anione oh-. Da lì sta dall'alcalinità di queste basi. Tuttavia, e come previsto, sono meno semplici di quelli che hanno già gli ioni oh- presente nei loro cristalli. Ad esempio, NaOH è estremamente semplice:
NaOH (S) → Na+(AC) + OH-(AC)
Bene, rilascio oh ioni- direttamente non appena l'acqua tocca; O peggio, tocca a malapena l'umidità della pelle.
Può servirti: carbocalizzazione: formazione, caratteristiche, tipi, stabilitàAltre proprietà fisiche o chimiche dei sali di base non differiscono troppo da quelle di altri sali neutri o acidi.
Nomenclatura
La nomenclatura dei sali di base dipende dalla natura dell'anione XO: se è monoatomica o se è un oxoanione. Tuttavia, questa sezione si concentrerà soprattutto sui sali di base con gli anioni oh-. Coloro che non li hanno, hanno nomenclature molto più facili da memorizzare o ragionare.
Con anioni monoatomici
Gli anioni monoatomici non sono rappresentati come xo, ma come x. Derivano da un idraceide HX, come acido fluoruro, HF o acido cloridrico, HCl e così via.
In questi casi, vengono sistematicamente nominati in due modi:
(Prefisso numerico tranne la scimmia) Nome idrossi + anione che termina con il suffisso -uro + nome del metallo con la sua valenza tra parentesi (se ha più di uno)
Ad esempio, Salt Ni (OH) CL è chiamato nichel hydrossicloruro (II).
Nome anione con terminazione -Uro + -(prefisso numerico tranne la scimmia) Nome idrossido + metallo e la sua valenza tra parentesi
Ad esempio, Salt Ni (OH) CL può anche essere nominato come cloruro-idrossido di nichel (II).
Abbiamo anche la nomenclatura tradizionale, a volte mescolata al sistematico:
Nome anione seguito da (prefisso numerico tranne la scimmia) di base e il nome del metallo con i suffissi -ooso o -ico come applicato.
Ad esempio, il Ni (OH) CL è chiamato cloruro di base del nichel o cloruro di nichel di base (II).
Con oxoanions
La nomenclatura sistematica per i sali di base che presentano oxoanioni è un po 'più complicata. Tuttavia, la versione più semplice è creata come segue:
(Prefisso numerico) idrossido- (nome anione) + di + nome metallico e il suo valencia tra parentesi
Ad esempio, fede (oh) no3 è chiamato: nitrato di ferro idrossido (II).
Ha anche la nomenclatura tradizionale:
Basic Nion + (numerale prefisso) Nome + Nome metallico che termina in -oso o -ico
Può servirti: ossigeno: proprietà, struttura, rischi, usiQuindi, fede (oh) no3 Si chiama: nitrato di base ferroso o nitrato di ferro di base (II).
Formazione
I sali di base sono il prodotto delle neutralizzazioni a base di acido, in particolare tra un'idrazia o un oxoacide con un eccesso di base o idrossido:
Base (in eccesso) + acido → sale di base o alcalino + acqua
Ad esempio, ca (oh) no3 È formato mediante acido nitrico neutralizzante con un eccesso di idrossido di calcio:
Ca (Oh)2(In eccesso) + hno3 → Ca (oh) no3 + H2O
Un'altra formazione di formazione sarebbe la seguente:
Faith (Oh)3(Eccesso) + H2SW4 → fe (oh) quindi4 + 2h2O
Questo sale è chiamato: solfato ferrico di base, solfato di ferro di base (III) o idrossido di ferro-solfato (III).
Esempi di sali di base
 Gli antiacidi, come il carbonato di calcio, Caco3, sono esempi di sali di base. Fonte: Pixabay.
Gli antiacidi, come il carbonato di calcio, Caco3, sono esempi di sali di base. Fonte: Pixabay. Infine, alcuni altri esempi di sali di base saranno elencati insieme ai loro nomi più semplici:
-Nach3COO: acetato di sodio
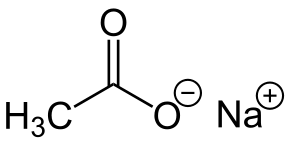 Acetato di sodio
Acetato di sodio -N / a2S: solfuro di sodio
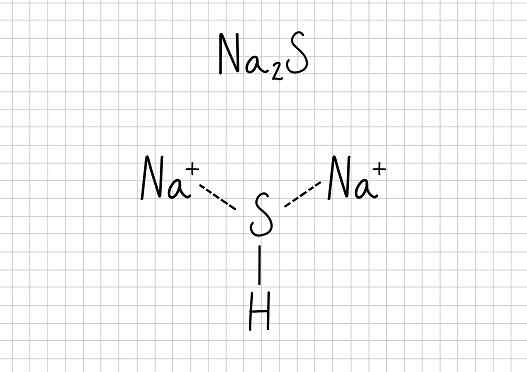 Solfuro di sodio
Solfuro di sodio -KCN: cianuro di potassio
-Mgco3: carbonato di magnesio
-Faith (Oh) Quindi3: Solfito di ferro di base (III)
-Faith (Oh) (C6H5COO)2: Benzoato di ferro di base (III)
-Aucl (oh)2: Cloruro dibasico d'oro (III)
-Cuclo3(OH): clorato di rame di base (ii)
-A (oh) così4: Solfato di base in alluminio
-PB (OH)2Co3: Carbonato di piombo dibasico (IV)
Il problema dei sali di base è che non tutti possono essere preparati, perché un eccesso di base o idrossido non è sufficiente per cristallizzarli senza ricorrere ad altri processi. Questo è il caso di Pb (OH)2Co3. Tuttavia, questo carbonato esiste come un pigmento di piombo bianco (II), la cui formula è 2PBCO3· PB (OH)2 o Pb3(OH)2(CO3)2.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2020). Sale alcali. Recuperato da: in.Wikipedia.org
- Wu c., Dowell c. & Hooper n. (1 luglio 2014). Proprietà acide-base dei sali. Recuperato da: Chem.Librettexts.org
- Nicola McDougal. (2020). Soluzioni sale acide e di base: spiegazione ed esempio. Studio. Recuperato da: studio.com
- Problema ed esercizi chimici. (S.F.). Sali di base. Recuperato da: Acurral.È
- « Concetto ed esempi Struttura materiale
- Caratteristiche della funzione sfalsate, esempi, esercizi »

