Caratteristiche, struttura, funzioni di Takera
- 2070
- 21
- Ruth Cattaneo
IL Sakera, Conosciuto anche come complesso tabera-isomaltasi, è un complesso enzimatico membrano con attività α-glicosilasi appartenente al gruppo di idrolasi complete (costituita da glicosidasi e peptidasi).
È presente nei microvie intestinali di molti animali terrestri come mammiferi, uccelli e rettili. Secondo diverse fonti bibliografiche, altri nomi accettati di questo enzima sono oligo-1,6-glucosidasi, α-metil glucosidasi, isomaltasi e oligosaccaride α-1,6-glucosidasi.
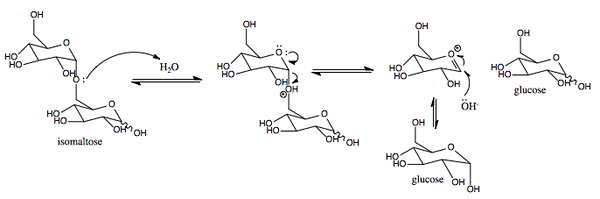
 Rappresentazione grafica del meccanismo d'azione dei sacca.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons)
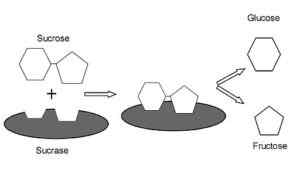
Rappresentazione grafica del meccanismo d'azione dei sacca.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons) È un enzima con attività simile all'inverto è stata trovata nelle piante e nei microrganismi. La sua funzione primaria è di idrolizzare il legame glucosidico tra monosaccaridi (glucosio e fruttosio) che compongono il saccarosio ingerito con il cibo.
Ha funzioni digestive molto importanti, poiché il saccarosio non può essere trasportato come disaccaride nelle cellule intestinali e, quindi, la sua idrolisi consente l'assorbimento intestinale dei suoi monosaccaridi costituenti.
La sintesi e l'attività dell'isomaltasi del trattore nelle cellule intestinali degli animali sono regolate a molti livelli: durante la trascrizione e la traduzione, durante la glicosilazione e anche durante la sua elaborazione post-traslazionale.
Quando uno di questi eventi fallisce o si verifica un qualche tipo di mutazione nel gene che lo codifica, nell'uomo c'è una condizione patologica nota come sindrome da carenza di saccarosio, che è correlata all'impossibilità di metabolizzare la disaccaridi.
[TOC]
Caratteristiche
I disaccaridi che fungono da substrato per i mammiferi nei mammiferi sono generalmente il prodotto dell'attività idrolitica degli enzimi salivari e delle α-amilasi pancreatiche. Ciò è dovuto al fatto che i sacas non solo idrolizzano i legami glucosidici del saccarosio, ma anche i legami α-1,4 del maltosio e del maltotriosa e di altri oligosaccaridi.
La mezza vita dello stesso varia tra 4 e 16 ore, quindi le cellule intestinali investono molto.
Può servirti: qual è la crenazione? (Biologia)Sintesi
Come la maggior parte degli enzimi idrolasi completi, i sackwaters (itasi-isomaltasi o sì) è una glicoproteina sintetizzata nelle cellule del bordo del pennello come un precursore polipeptidico indicato pro-if.
Questa molecola precursore viene trasportata sulla superficie apicale delle cellule e c'è enzimaticamente elaborato da proteasi pancreatiche che la dividono in due diverse subunità: la subunità isomaltasi e la subunidad Subunidad.
La subunità isomaltasi corrisponde all'estremità amminica terminale del pro-Si e ha un segmento idrofobico (ancoraggio idrofobo) alla sua estremità N-terminale. Ciò consente di associarti alla membrana plasmatica delle cellule intestinali con il bordo del pennello.
Il gene che codifica questo complesso nell'uomo si trova nel lungo braccio del cromosoma 3 e data la grande omologia della sequenza tra le due subunità (oltre il 40%), è stato suggerito che questo enzima è nato attraverso un evento di duplicazione genetica.
È stato dimostrato che entrambe le subunità, l'isomaltasi e i sacas sono in grado di idrolizzarsi.
Struttura
La forma iniziale dell'enzima sacas, il polipeptide pro-Si, ha circa 260 kDa e 1827 aminoacidi. Tuttavia, l'attività proteolitica delle proteasi pancreatiche produce due subunità di 140 kDa e 120 kDa, che rappresentano l'isomaltasi e le sacara, rispettivamente.
Questo enzima è una glicoproteina con porzioni saccaride N- E O-Glicosiladas e gli studi della loro sequenza rivelano la presenza di oltre 19 siti di glicosilazione. Le porzioni di carboidrati rappresentano oltre il 15% del peso della proteina e sono essenzialmente composte da acido sinalico, galattosamina, mano e N-acetilglucosamina.
Può servirti: leucina: caratteristiche, struttura, funzioni, biosintesiPoiché le due subunità del complesso sacrase-isomaltasi non sono esattamente le stesse, molti autori considerano che questo enzima è, in realtà, un eterodimero in cui ogni subunità è costituita da una catena polipeptide lineare glicosilata e che è associato.
La subunità isomaltasi ha un segmento idrofobico di 20 rifiuti di aminoacidi che è coinvolto nella sua associazione con la membrana degli enterociti (cellule intestinali) e che rappresentano un ancoraggio permanente e un segnale peptidico per andare al reticolo endoplasmatico.
Il sito attivo di entrambe le subunità, sacas e isomaltasi, si trova nella membrana plasmatica degli enterociti, che sporge verso il lume intestinale.
Funzioni
Le principali funzioni metaboliche di enzimi come il pretendente-isomaltasi sono correlate alla produzione di glucosio e fruttosio dal saccarosio. Monosaccaridi trasportati in cellule intestinali e che sono incorporati in diverse rotte metaboliche con scopi diversi.
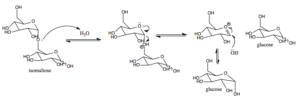 Meccanismo d'azione dell'isomaltasi di zucchero nei mammiferi (fonte: AREID3 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons)
Meccanismo d'azione dell'isomaltasi di zucchero nei mammiferi (fonte: AREID3 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons) Il glucosio, per i quali esistono trasportatori specifici, può essere diretto intracellulare verso la glicolisi, ad esempio, dove la sua ossidazione porta alla produzione di energia sotto forma di ATP e riducendo il potere sotto forma di NADH.
Il fruttosio, d'altra parte, può anche essere metabolizzato da una serie di reazioni che iniziano con la sua fosforilazione in 1-fosfato di fruttosio e catalizzato da una fruttocinasi epatica. Questo inizia l'inclusione di questo substrato ad altre rotte di produzione di energia.
Inoltre, come con l'enzima invertito nelle piante, l'attività dello zucchero-isomaltasi ha importanti implicazioni in aspetti cellulari come la pressione osmotica, che di solito condizionano eventi fisiologici come crescita, sviluppo, trasporto di molecole e altri.
Malattie correlate all'uomo
C'è una malattia autosomica congenita nell'uomo noto come pretendente-isomaltasa o carenza di CSID (inglese Carenza congenita di lindy-isomaltasi), che è correlato ai difetti nei disaccaridi di digestione e osmoticamente oligo.
Può servirti: effetto fondatoreQuesta malattia ha a che fare con diversi fattori simultanei, tra cui l'errore di perseguimento della forma precursore pro-if dell'enzima, mutazioni genetiche, errori durante il trasporto ecc.
Questa condizione è difficile da diagnosticare, essendo spesso confusa con un intolleranza al lattosio. Pertanto, è anche noto come "intolleranza al saccarosio".
È caratterizzato dallo sviluppo di crampi addominali, diarrea, vomito, jaquecas accompagnati da ipoglicemia, mancanza di crescita e aumento di peso, ansia e produzione eccessiva di gas.
Riferimenti
- Brunner, j., Hauser, h., Braun, h., Wilson, k., Wecker, w., O'Neill, b., E semenza, g. (1979). La modalità di associazione del complesso enzimatico Lygase-isomaltasi con la membrana del bordo del pennello intestinale. Il Journal of Biological Chemistry, 254(6), 1821-1828.
- Cowell, g., Tranum-Jensen, j., Sjöström, h., & Norén, o. (1986). Topologia e struttura quaternaria della pro-sucrasi / isomaltasi e in forma finale simulata / isomaltasi. Diario biochimico, 237, 455-461.
- Hauser, h., E semenza, g. (1983). Limade-isomaltasi: una proteina intrinseca steccata della membrana del bordo del pennello. Recensioni critiche in Bioch, 14(4), 319-345.
- Hunziker, w., Spiesss, m., SEMENZA, g., & Lodish, H. F. (1986). Il complesso Limade-Lsomaltasi: struttura primaria, orientamento della membrana ed evoluzione di una proteina bordo a pennello intrinseco e inseguita. Cellula, 46, 227-234.
- Naim, h. E., Roth, j., Sterchi, e. E., Lentze, m., Miglio, p., Schmitz, j., & Hauril, H. (1988). Carenza di lind-isomaltasi negli esseri umani. J. Clin. Investire., 82, 667-679.
- Rodriguez, i. R., Taravel, f. R., & Whelan, W. J. (1984). Caratterizzazione e funzione della linde-isomaltasi intestinale di maiale e delle sue subunità separate. euro. J. Biochimico., 143, 575-582.
- Schiweck, h., Clarke, m., & Pollach, G. (2012). Zucchero. In L'enciclopedia di chimica industriale di Ullmann (Vol. 34, p. 72). Wiley-VCH Verlag GmbH & Co. Kgaa.
- TREEM, W. (1995). Carenza congenita di lindy-isomaltasi. Journal of Pediatric Gastroenterology and Nutrition, ventuno, 1-14.
- « Caratteristiche della gastrina, struttura, produzione, funzioni
- Gli 11 tipi principali di ingegneria e le loro caratteristiche »

