Regola del lavandino o la massima molteplicità
- 3493
- 390
- Enzo De Angelis
Spieghiamo quale sia la regola dell'Hund o il principio della massima molteplicità, passi per applicarla e dare diversi esempi
 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar Qual è la regola del lavandino?
IL Regola di affondare, Chiamato anche Principio di Moltiplicità massimo dello spin, è una regola empirica che viene utilizzata per scrivere la configurazione elettronica assoluta degli elementi chimici quando si trovano nel loro stato fondamentale. Cioè, è una regola che aiuta a prevedere come gli elettroni sono distribuiti negli orbitali atomici di un atomo che è rilassato o al suo livello più basso di energia.
La regola di Sink dice:
"... In un atomo che si trova nel suo stato fondamentale, gli elettroni dello stesso livello di energia saranno distribuiti in modo tale che ci sia il più possibile delle spine parallele".
Questa regola corrisponde a uno dei principi fondamentali della meccanica quantistica e della teoria atomica attuale. È molto utile comprendere alcune proprietà dei diversi elementi, in particolare le loro proprietà magnetiche. Questo perché gli atomi sono attratti o respinti da magneti mentre sono scomparsi nella loro struttura nella loro struttura.
Da dove viene il lavandino o la massima regola di molteplicità?
Spettri atomici
Questo principio ha enunciato per la prima volta il fisico tedesco Friedrich Hund nel 1927. Sink ha studiato gli spettri di assorbimento atomico, che consentono di misurare sperimentalmente l'energia che gli elettroni assorbono quando esposti alla radiazione elettromagnetica di un'adeguata lunghezza d'onda. Osservazioni sperimentali potevano essere spiegate solo se l'atomo possedesse il maggior numero possibile di elettroni con lo stesso giro.
Elettroni mancanti
Oltre agli spettri atomici, ci sono altre osservazioni sperimentali che confermano le configurazioni elettroniche che sono previste applicando la regola Hund. Il più importante è costituito dalle misure sperimentali delle proprietà magnetiche degli atomi che consentono di determinare quanti elettroni mancanti hanno un atomo.
Può servirti: elettrolisi dell'acquaGli elettroni mancanti sono quelli che sono soli in un orbitale, senza la rispettiva coppia di spin opposte.
Passaggi per applicare la regola del lavandino
La regola del lavandino si applica quando scriviamo la configurazione elettronica di un atomo nel suo stato fondamentale. Ciò significa che è una regola complementare di altre regole, come il principio di Aufbau o il principio di costruzione (chiamato anche la regola della pioggia) e il principio di esclusione di Pauli.
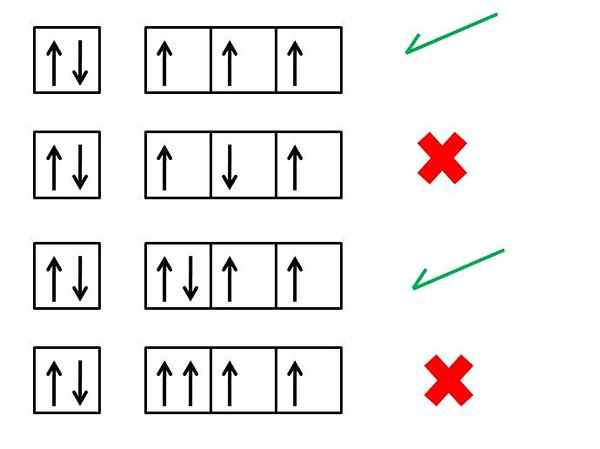
Si applica solo a quei casi in cui vogliamo.
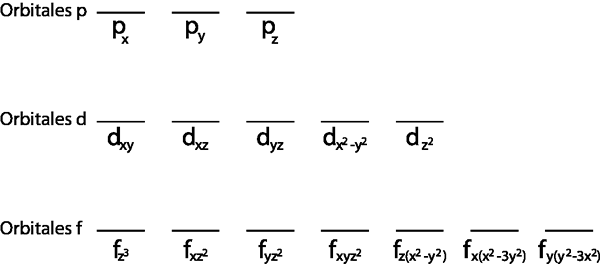
Inoltre, ha senso applicarlo solo per lo strato di Valencia, cioè quel livello di energia incompleto (non ha tutti gli elettroni che si adattano in esso). Altrimenti, tutti gli elettroni sarebbero accoppiati per rispettare il principio di esclusione di Pauli.
L'applicazione di questa regola consiste nei seguenti passaggi:
- Passaggio 1: disegnare una linea orizzontale o un piccolo rettangolo per ciascun orbitale del sottotitolo.
- Passaggio 2: posizionare il primo elettrone nel primo orbitale con il tuo rotazione rivolto verso l'alto.
- Passaggio 3: posizionare il seguente elettrone nel prossimo orbitale, anche rivolto verso l'alto.
- Passaggio 4: continua così fino a quando gli elettroni sono finiti o non ci sono più orbitali vuoti.
- Passaggio 5: se quando si posiziona un elettrone in ciascun orbitale ci sono ancora elettroni da distribuire, ripetere i passaggi da 2 a 4 ma posizionando gli elettroni con il loro rotazione rivolto verso il basso.
Per capire come si applicano questi passaggi, analizziamo un paio di esempi.
Esempio 1: configurazione elettronica azotata
L'azoto è l'elemento numero 7, quindi ha un totale di 7 elettroni che ruotano attorno al nucleo. Questi elettroni sono distribuiti come segue, seguendo la regola della pioggia:
Può servirti: acetanilide (c8h9no)1s2 2s2 2 p3
Come possiamo vedere, lo strato di valenza dell'azoto corrisponde al livello 2 di energia (chiamato strato L) in cui si adattano 8 elettroni. Tuttavia, l'azoto ha solo 5 elettroni Valencia.
Negli orbitali S Solo 2 elettroni si adattano, quindi l'orbitale 2S è completamente pieno e non ha senso applicare la regola del lavandino per questo orbitale.
D'altra parte, il livello secondario 2p, che contiene 3 orbitali, non è pieno. Ma come vengono distribuiti questi 3 elettroni in quei tre orbitali? Sono distribuiti seguendo i passaggi della regola del lavandino, che sono presentati di seguito:
Passaggio 1: disegnare una linea orizzontale o un piccolo rettangolo per ciascun orbitale del sottotitolo.
Poiché è il sotto -livello 2p, ci sono tre orbitali che sono il 2pX, 2 pE e il 2pz. Quindi, dobbiamo disegnare tre strisce orizzontali o tre scatole o rettangoli:
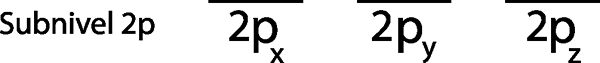
Ognuna di queste strisce o scatole rappresenta un orbitale, come indicato dal nome che ha ciascuno di essi.
Passaggio 2: posizionare il primo elettrone nel primo orbitale con il tuo rotazione rivolto verso l'alto.
Posizioniamo il primo elettrone nell'orbitale 2pX Poiché questo è il primo orbitale nell'elenco.
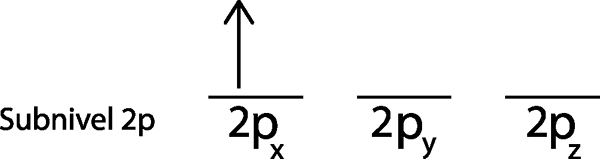
Passaggio 3: posizionare il seguente elettrone nel prossimo orbitale, anche rivolto verso l'alto.
Il secondo elettrone si trova nell'orbitale 2pE
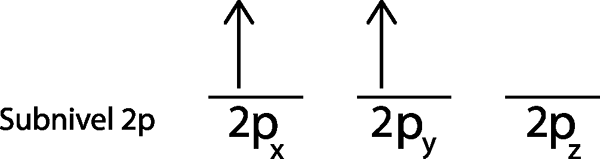
Passaggio 4: continua così fino a quando gli elettroni sono finiti o non ci sono più orbitali vuoti.
Nel nostro caso, dobbiamo solo distribuire 3 elettroni, quindi dobbiamo solo posizionare l'ultimo elettrone nell'ultimo orbitale e voilà:
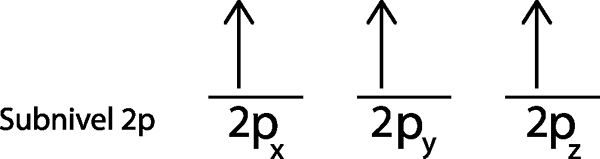
Come si può vedere, il principio della massima molteplicità o regola del lavandino prevede che l'azoto atomico deve avere 3 elettroni mancanti.
Può servirti: ossidi di azoto (NOX)In questo caso, non era necessario applicare il passaggio 5, poiché dopo il passaggio 4 siamo rimasti senza elettroni per distribuire.
Esempio 2: configurazione elettronica di ferro
Il ferro è l'elemento 26 e la sua configurazione elettronica è:
1s2 2s2 2 p6 3s2 3p6 3d6 4s2
In questo caso, possiamo notare che l'orbitale con il più alto livello di energia è 4s, ma poiché è un metallo di transizione, il ferro ha un orbitale parzialmente pieno. Questo è l'orbitale i cui elettroni distribuiremo seguendo la regola Hund.
Passaggio 1: disegnare una linea orizzontale o un piccolo rettangolo per ciascun orbitale del sottotitolo.
Riempiremo il sottotitolo 3D che contiene 5 orbitali:
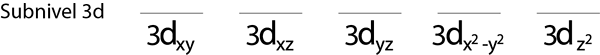
Passaggio 2: posizionare il primo elettrone nel primo orbitale con il tuo rotazione rivolto verso l'alto.
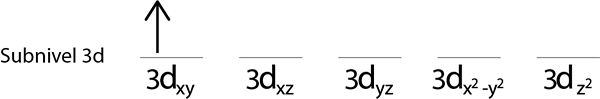
Passaggi 3: posizionare il seguente elettrone nel seguente orbitale, anche rivolto verso l'alto.
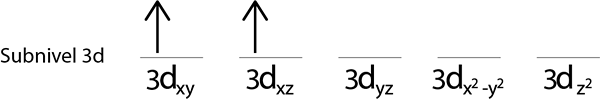
Passaggio 4: continua così fino a quando gli elettroni sono finiti o non ci sono più orbitali vuoti.
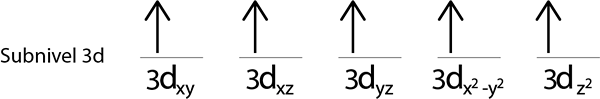
Passaggio 5: se quando si posiziona un elettrone in ciascun orbitale ci sono ancora elettroni da distribuire, ripetere i passaggi da 2 a 4 ma posizionando gli elettroni con il loro rotazione rivolto verso il basso.
Dato che abbiamo ancora un elettrone da distribuire dopo aver posizionato un elettrone in ciascun orbitale 3D, l'ultimo dei 6 elettroni viene posizionato con la rotazione opposta nel primo orbitale.
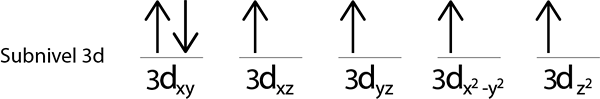
Questa è la configurazione assoluta di un atomo di ferro nel suo stato fondamentale. Allo stesso modo, il ferro ha 4 elettroni mancanti con spine parallele.
Riferimenti
- Senza risposta domande sulla massima multiplicità o sulla regola del lavandino: cosa si dovrebbe fare (2020). Tratto dalla fisica e dallaquimica.com.
- Sink - Chimica (2021). Preso da costproject.org.
- Moltiplicità massima di Sind (2020). Preso da Principiode.com.
- Regola del lavandino | The Chemistry Guide (2012). Preso dalla chimica.Laguia2000.com.

