I radicali affittano come si formano, nomenclatura, esempi
- 3232
- 536
- Benedetta Rinaldi
IL RADI RADICALI Sono un insieme di molecole instabili che provengono dalla perdita di idrogeni di un alcano. Sono caratterizzati da un elettrone scomparso, quindi reagiscono rapidamente per completare l'ottetto di Valencia dell'atomo dove si trova.
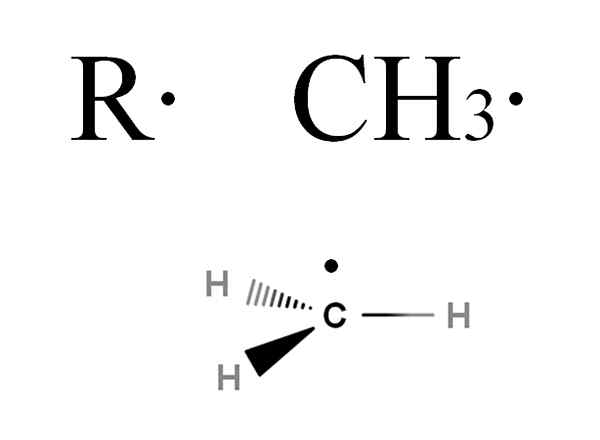
Questi radicali sono simboleggiati con la lettera R, così come i gruppi di noleggio, ma con la differenza che viene aggiunto un punto, r ·. Questo punto indica che la presenza di un elettrone è scomparsa. Ad esempio, considera il gas metano, Cho4. Questo alcano, perdendo uno dei suoi idrogeni, verrà trasformato in metil radicale, Cho3· (Immagine sotto).
 Formula generale di un alchil radicale e metil radicale. Fonte: Gabriel Bolívar via Molview.
Formula generale di un alchil radicale e metil radicale. Fonte: Gabriel Bolívar via Molview. Se vuoi approfondire un po 'la struttura radicale CH3·, Si vedrà che il suo elettrone scomparso è ad angolo perpendicolare ai collegamenti C-H; cioè, si trova in un orbitale P puro. Pertanto, Cho3· Adottare un'ibridazione SP2, così come, in generale, con altri radicali alchilici.
Questi radicali sono la pietra angolare delle reazioni a catena in cui partecipano gli alcani, come nel caso delle loro alogenizioni: clorazione, bromazione, ecc. Ci sono 1 °, 2 ° e 3 ° radicali, nonché vinile e alilici, ognuno con la loro rispettiva stabilità e facilità di allenamento.
[TOC]
Come sono formati i radicali alchilici?
La reazione "più semplice" per la quale si formano i radicali è l'alogenazione degli alcani. Per formare, deve essere somministrata la reazione a catena, che si verifica solo ad alte temperature (superiori a 250 ºC) o sotto l'incidenza della luce ultravioletta a temperatura ambiente.
Può servirti: solfito di sodio (Na2SO3)Considera la clorazione del metano in una delle condizioni sopra menzionate:
Cl2 → 2cl ·
L'energia fornita è sufficiente per rompere il collegamento CL-CL della molecola di cloro, che si verifica una pausa omolitica; Cioè, ogni atomo di cloro rimane con uno degli elettroni di collegamento. Pertanto, si formano due radicali.
Quindi, un cl · radicale attacca una molecola di metano:
Cl · + CH4 → HCL + CH3·
E appare il metil radicale. Questo ch3· È abbastanza instabile, quindi reagirà immediatamente per vincere un elettrone extra con il quale apparirà il suo elettrone solitario:
Cap3· + Cl2 → Ch3Cl + Cl ·
La formata reagirà con un'altra molecola di metano e il ciclo verrà ripetuto più volte. Man mano che si esaurisce il metano, si verificheranno le seguenti reazioni che terminano la reazione a catena:
CL · + · CL → CL2
Cap3· + · Cho3 → Ch3Cap3
Cap3· + · Cl → CH3Cl
Stabilità relativa
Cap3
Il metano non è l'unico alcano che è "radicalizzato" dalla clorazione. Succede anche lo stesso con etano, propano, butano e altri isomeri. Tuttavia, ciò che varia è l'energia necessaria che deve essere fornita in modo che i radicali cl · disidroga una molecola di alcano. Nel caso del radicale metilico, è molto instabile e, quindi, difficile da formare.
Pertanto, il radicale Cho3Cap2· È più stabile e facile da formare di Cho3·. Perché? Perché il radicale ch3Cap2· È primario, 1 °, il che significa che l'elettrone scomparso è su un atomo di carbonio collegato a un altro carbonio. Nel frattempo, Cho3Non appena è legato agli atomi di idrogeno.
Può servirti: fluoro: storia, proprietà, struttura, ottenimento, rischi, usiCosa riguarda? Ricordando la rappresentazione precedente, l'elettrone scomparso si trova in un orbitale P, perpendicolare agli altri collegamenti. Pollice3·, Gli atomi di idrogeno donano a malapena la densità elettronica all'atomo di carbonio, nel tentativo di compensare la mancanza di un altro elettrone.
1 °
Pollice3Cap2·, D'altra parte, il carbonio con l'elettrone scomparso è collegato a due idrogeni e un gruppo metilico. Di conseguenza, questo carbonio riceve una maggiore densità elettronica, il che aiuta a stabilizzare un po 'l'elettrone. La stessa spiegazione è valida per altri 1 ° alkynd radicali.
2 °
In un radicale secondario o 2 ° alquil, come il radicale isopropil (CH3)2C. Pertanto, è più stabile del primo e dei radicali metilici.
3 °
Abbiamo anche radicali terziari o 3 ° alkynd, come il radicale ter-butil3)3C ·. Questi sono più stabili della prima e del 2 °. Ora, ci sono tre gruppi gassati diversi dall'atomo di idrogeno che stabilizzano l'elettrone scomparso.
Allilico e vinile
Vale anche la pena menzionare i radicali allilici, Cho2= Ch-ch2· E vinile, Cho2= Ch ·.
Alilic è il più stabile di tutti. Questo perché l'elettrone scomparso è persino in grado di spostarsi sull'atomo di carbonio dell'altra estremità. Il Vínilico, d'altra parte, è il più instabile di tutti, dal momento che il gruppo CHO2=, più acido, attira la densità elettronica verso se stesso invece di donarlo verso il carbonio con l'elettrone è scomparso.
Può servirti: idrossido di piombo: struttura, proprietà, usi, rischiIn sintesi, la stabilità relativa dei radicali alkynd, dai più alti ai più bassi, sono:
Alilo> 3 °> 2nd> 1st> Vinyl
Nomenclatura
La nomenclatura dei radicali alchil è la stessa per i remedie. Quindi, Cho3Cap2· È chiamato radicale etilico; e il radicale ch3Cap2Cap2Cap3, N-butyl.
Affitto radicali principali
I principali radicali alchilici coincidono con i gruppi alchilici: sono quelli che hanno meno di sei atomi di carbonio. Pertanto, i radicali sono derivati da metano, etano, propano, butano e pentano, sono i più comuni. Allo stesso modo, il vinile radicale e gli allilicos fanno parte di questo elenco.
Altri radicali alchidici che si trovano meno frequentemente sono quelli che derivano da cicloalcani, come il ciclobutano, il ciclobutano o il ciclopentano.
Nella seguente immagine molti di questi radicali sono rappresentati con lettere assegnate:
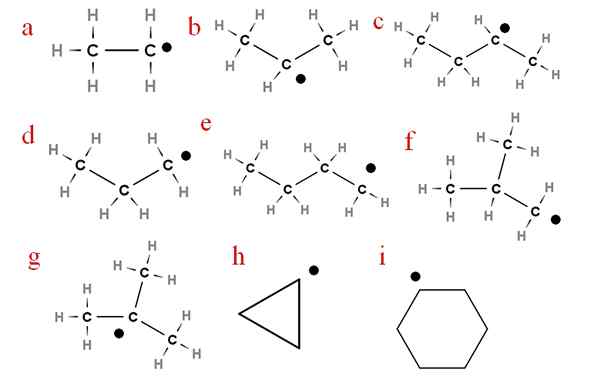 Nove dei più importanti radicali per le alchery. Fonte: Gabriel Bolívar.
Nove dei più importanti radicali per le alchery. Fonte: Gabriel Bolívar. A partire dalla lettera "A", abbiamo:
-a, radicale etilico
-B, radicale isopropilico
-C, seccutile radicale
-D, propil radicale
-E, radicale N-butyl
-F, isobutil radicale
-G, ter-butil radicale
-H, cycropilus radicale
-Io, ciclohexil radicale
Ognuno di questi radicali può o meno avere i loro idrogeni sostituiti da altri gruppi, quindi sono ugualmente vari come gli alcani e i loro isomeri strutturali.
Riferimenti
- Morrison, r. T. e Boyd, r, n. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Inter-American.
- Carey f. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. (10a edizione.). Wiley Plus.
- Wikipedia. (2020). Alchil. Recuperato da: in.Wikipedia.org
- Chimica librettexts. (5 giugno 2019). Struttura dei radicali alchilici: iperconjugation. Recuperato da: Chem.Librettexts.org
- « Concetto di riferimenti incrociati, funzioni, esempi
- Caratteristiche degli animali acquatici, respirazione, tipi, esempi »

