Tipi di cheratina, struttura, posizione e funzioni
- 1986
- 47
- Ruth Cattaneo
IL cheratina È una proteina fibrosa insolubile che è una parte strutturale delle cellule e degli integri di molti organismi, in particolare degli animali vertebrati. Ha forme molto varie ed è poco reattivo, chimicamente.
La sua struttura è stata descritta per la prima volta dagli scienziati Linus Pauling e Robert Corey nel 1951, analizzando la struttura dei capelli animali. Questi ricercatori hanno anche dato indicazioni sulla struttura della miosina del tessuto muscolare
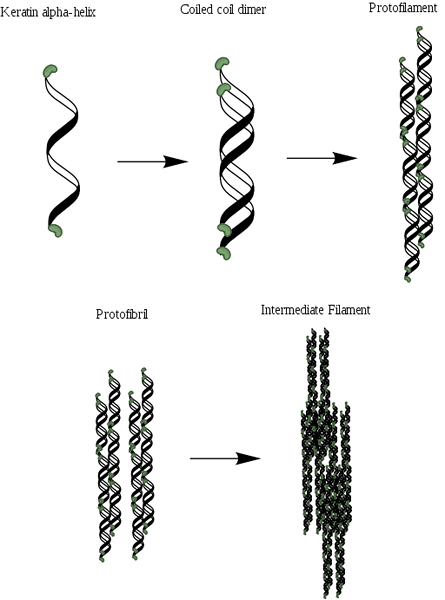
 Schema di organizzazione Alfa-Queratin (fonte: MLPatton [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons)
Schema di organizzazione Alfa-Queratin (fonte: MLPatton [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons) Dopo il collagene, è una delle proteine più importanti degli animali e rappresenta la maggior parte del peso secco di capelli, lana, unghie, artigli e zoccoli, piume, corna e parte sostanziale dello strato esterno della pelle.
Gli elementi "cheratinizzati" degli animali possono avere morfologie molto diverse che dipendono, in larga misura, dalla funzione che esercitano in ogni particolare organismo.
La cheratina è una proteina che ha caratteristiche che le danno una grande efficienza meccanica in termini di tensione e compressione. È prodotto da un tipo speciale di cellule che sono chiamate "cheratinociti", che di solito muoiono dopo averlo prodotto.
Alcuni autori affermano che le cheratine sono espresse in uno stadio in tessuto e stadio. Nell'uomo ci sono più di 30 geni codificanti per queste proteine e questi appartengono a una famiglia che si è evoluta per diversi round di duplicazione genetica.
[TOC]
Tipi di cheratine e la loro struttura
Ci sono, essenzialmente, due tipi di cheratine: α e β. Questi si distinguono possedendo una struttura di base che è principalmente composta da catene polipeptidiche che possono essere iscritte come eliche alfa (α-queratina) o unire in parallelo come fogli β (β-coap).
α-Queratinas
Questo tipo di cheratina è il più studiato ed è noto che i mammiferi hanno almeno 30 diverse varianti di questo tipo di cheratina. In questi animali, α-che fanno parte di unghie, capelli, corna, caschi, picchi ed epidermide.
Come il collagene, queste proteine contengono nella loro struttura una percentuale abbondante di piccoli aminoacidi come glicina e alanina, che sono quelli che rendono possibile l'istituzione di eliche alfa. La struttura molecolare di un'α-queratina è costituita da tre diverse regioni: (1) fibrille o eliche cristalline, (2) i domini terminali dei filamenti e (3) la matrice.
Le eliche sono due e formano un dimero che ricorda una spirale a spirale che rimane unita grazie alla presenza di collegamenti o ponti disulfur. Ciascuna delle eliche ne ha circa 3.6 rifiuti di aminoacidi in ogni turno che dà e consiste in più o meno 310 aminoacidi.
Può servirti: flora e fauna della Sierra ecuadoriana: specie rappresentativeQueste spirali a spirale possono quindi essere associate per formare una struttura nota come protofilamento o protofibrilla, che ha la capacità di assemblare con altri dello stesso tipo.
I protofilamenti hanno estremità non elicoidali N e C-terminali ricche di residui di cisteina e che sono attaccati alla regione centrale o alla matrice. Queste molecole polimerizzano per formare i filamenti intermedi che hanno un diametro vicino a 7nm.
Si distinguono due tipi di filamenti intermedi composti dalla cheratina: i filamenti acidi intermedi (tipo I) e le basi (tipo II). Questi sono incorporati in una matrice proteica e il modo in cui questi filamenti vengono ordinati influenza direttamente le proprietà meccaniche della struttura che compongono.
Nei filamenti di tipo I, le eliche si collegano tra loro per mezzo di tre "connettori elicoidali" noti come L1, L12 e L2 e che si ritiene offrano flessibilità al dominio elicoidale. Nei filamenti di tipo II ci sono anche due sottodomini che sono tra i domini elicoidali.
Esempio di una struttura con α-queratina: capelli
Se viene analizzata la struttura di un capelli tipico, ha un diametro approssimativo di 20 micron ed è composta da cellule morte contenere.
 I capelli dei mammiferi, come questa mucca, sono composti da cheratina (fonte: Frank Winkler via Pixabay.com)
I capelli dei mammiferi, come questa mucca, sono composti da cheratina (fonte: Frank Winkler via Pixabay.com) Le macropibrille sono costituite da microfibrille, che hanno meno diametro e si uniscono tra loro attraverso una sostanza proteica amorfa con un alto contenuto di zolfo.
Queste microfibrille sono gruppi di protofibrille più piccole con un modello di organizzazione 9+2, il che significa che nove protofibrillas circondano due protofibrille centrali; Tutte queste strutture sono essenzialmente composte da α-ceratina.
Cheratine morbide e cheratine dure
A seconda del contenuto di zolfo che hanno, le α-curatina possono essere classificate come cheratine morbide o cheratine dure. Ciò ha a che fare con la forza di resistenza meccanica imposta dai collegamenti disolfuro nella struttura proteica.
Nel gruppo di cheratine dure, sono incluse quelle che fanno parte dei capelli, delle corna e delle unghie, mentre i cheratine morbide sono rappresentate dai filamenti che si trovano nella pelle e i calli.
I legami disolfuro possono essere eliminati applicando un agente riducente, quindi le strutture composte dalla cheratina non sono facilmente digeribili dagli animali, a meno che non abbiano un intestino ricco di merce, come nel caso di alcuni insetti.
Può servirti: ficologiaβ-curatina
Β-che sono molto più forti di α-Queratinas e si trovano nei rettili e negli uccelli come parte di artigli, scale, piume e picchi. Nei gecko, i microvicini trovati nelle gambe (funghi) sono anche composti da questa proteina.
La sua struttura molecolare è composta da fogli β-pedie formati da catene polipeptidiche antiparallete che si legano insieme attraverso legami o ponti idrogeno. Queste catene, una accanto all'altra, formano piccole superfici rigide e piatte, leggermente piegate.
Dove sei e quali sono le tue funzioni?
Le funzioni di cheratina sono correlate, soprattutto, al tipo di struttura che costruisce e al luogo del corpo dell'animale dove si trova.
Come altre proteine fibrose, ciò conferisce stabilità e rigidità strutturale alle cellule, poiché appartiene alla grande famiglia di proteine nota come famiglia di filamenti intermedi, che sono proteine del citoscheletro.
In protezione e copertura
Lo strato superiore della pelle degli animali superiori ha una vasta rete di filamenti intermedi formati dalla cheratina. Questo strato è chiamato epidermide e ha uno spessore di 30 micron e 1 nm nell'uomo.
L'epidermide funziona come una barriera protettiva contro diversi tipi di stress meccanico e chimico ed è sintetizzata da un tipo speciale di cellule chiamate "cheratinociti".
Oltre all'epidermide, c'è uno strato ancora più esterno che si muove costantemente.
Espinas e Púas sono anche usati da vari animali per la propria protezione contro i predatori e altri aggressori.
L'armatura delle pangoline, alcuni piccoli mammiferi insettivori che abitano l'Asia e l'Africa, è anche composta da "scale" della cheratina che li proteggono.
In difesa e altre funzioni
Le corna sono osservate negli animali della famiglia Bovidae, cioè in mucche, pecore e capre. Sono strutture molto forti e resistenti e gli animali che le fanno impiegare come difesa e corpi di corteggiamento.
Le corna sono formate da un centro osseo composto da osso "spugnoso" coperto da una pelle che viene proiettata dalla zona posteriore del cranio.
 I chiodi sono un altro esempio di parti del corpo composte da cheratina (fonte: stock di Adobe tramite Pixabay.com)
I chiodi sono un altro esempio di parti del corpo composte da cheratina (fonte: stock di Adobe tramite Pixabay.com) Gli artigli e le unghie, oltre alle loro funzioni in cibo e supporto, servono anche gli animali come difesa di "armi" contro aggressori e predatori.
Può servirti: teoria del fissaggio: concetto, postulati e autoriLe cime degli uccelli soddisfano diversi scopi, tra cui cibo, difesa, corteggiamento, scambio di calore e toilette, tra gli altri. Varietà multiple di PICOS negli uccelli si trovano in natura, specialmente in termini di forma, colore, dimensioni e resistenza delle mascelle associate.
I picchi sono composti, così come le corna, da un centro osseo proiettato dal cranio ed è coperto da fogli β-coratina resistenti.
I denti di animali nonmilutati (vertebrati "ancestrali") sono composti da cheratina e, come i denti dei vertebrati "superiori", hanno molteplici funzioni in cibo e difesa.
Nel movimento
I caschi di molti animali ruminanti e ugulati (cavalli, asini, alces, ecc.) Sono composti da cheratina, sono molto resistenti e progettati per proteggere le gambe e collaborare al movimento.
Le piume, che sono anche usate dagli uccelli per muoversi, sono composte da β-Cheap. Queste strutture, inoltre, hanno funzioni nel camuffamento, nel corteggiamento, nell'isolamento termico e in impermeabilità.
 Le piume e il picco degli uccelli sono anche composti da cheratina (fonte: coeleur, tramite Pixabay.com)
Le piume e il picco degli uccelli sono anche composti da cheratina (fonte: coeleur, tramite Pixabay.com) Nell'industria
L'industria tessile è uno dei principali sfruttatori delle strutture cheratinizzate, parlando antropocentricamente. La lana e i capelli di molti animali sono importanti a livello industriale, perché con loro vari capi che sono utili agli uomini da vari punti di vista sono fabbricati.
Riferimenti
- Koolman, j., & Roehm, K. (2005). Atlante di colore biochimica (2nd ed.). New York, USA: Thieme.
- Mathews, c., Van Holde, K., & Ahern, K. (2000). Biochimica (3 ° ed.). San Francisco, California: Pearson.
- Nelson, d. L., & Cox, m. M. (2009). Principi di biochimica Lechinger. Omega Editions (5 ° ed.).
- Pauling, l., & Corey, R. (1951). La struttura dei capelli, dei muscoli e delle proteine correlate. Chimica, 37, 261-271.
- Phillips, d., Korge, b., & James, W. (1994). Cheratina e cheratinizzazione. Journal of American Academy of Dermatology, 30(1), 85-102.
- Rouse, j. G., & Dyke, m. E. Andare. (2010). Una revisione dei biomateriali a base di cheratina per applicazioni biomediche. Materiali, 3, 999-1014.
- Smith, f. J. D. (2003). La genetica molecolare dei disturbi della cheratina. Am J Clin Dermatol, 4(5), 347-364.
- Voet, d., & Voet, J. (2006). Biochimica (3 ° ed.). Pan -American Medical Editoriale.
- Wang, b., Yang, w., McKitrick, J., & Meyers, M. A. (2016). Cheratina: struttura, proprietà meccaniche, occorrenza negli organismi biologici e sforzi di bioinspirazione. Progressi nella scienza dei materiali.
- « Nuova Spagna e relazioni con il background mondiale, rotte
- Caratteristiche di apprendimento della ripetizione, vantaggi, svantaggi »

