Cos'è la cinetica chimica?

- 4348
- 226
- Benedetta Rinaldi
Spieghiamo cos'è la cinetica chimica, l'ordine e la velocità di reazione e i fattori che influenzano la velocità
Cos'è la cinetica chimica?
IL Cinetica chimica È il ramo della chimica che è responsabile dello studio della velocità delle reazioni chimiche, quali fattori influenzano questa velocità e quali sono i singoli meccanismi o passaggi attraverso i quali si verificano reazioni chimiche.
Inoltre, ci consente di comprendere molti aspetti delle reazioni chimiche come l'equilibrio chimico e l'energia di attivazione e studia i processi di catalisi. Quest'ultimo lo rende particolarmente importante in più applicazioni, dalla biochimica all'ingegneria industriale.
Al centro della cinetica è la velocità di reazione, che può essere intesa come la velocità con cui i reagenti vengono trasformati in prodotti. Tuttavia, nella cinetica chimica esiste una definizione molto più precisa.
Definizione di velocità di reazione
Per dare la definizione completa della velocità di reazione, utilizzata nella cinetica chimica, iniziamo con la seguente reazione chimica generica:
In questa reazione, A e B rappresentano i reagenti, C e D rappresentano i prodotti, mentre A, B, C E D Rappresentano i rispettivi coefficienti stechiometrici.
La velocità di reazione (rappresentata con il simbolo v) Indica quanto velocemente. Matematicamente, questo è espresso come segue:
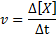
Dove Δ [x] rappresenta la variazione della concentrazione molare delle specie x (a, b, c o d) nell'intervallo di tempo Δt.
È evidente che più velocemente viene consumato uno qualsiasi dei reagenti, più velocemente gli altri reagenti verranno consumati e più velocemente si verificheranno i prodotti. Per questo motivo, è solo necessario definire la velocità in termini di uno di essi.
Può servirti: metodi di separazione delle miscele omogeneePer garantire che il risultato del calcolo della velocità sia sempre lo stesso, indipendentemente da quale specie è definita la velocità, deve essere sempre divisa tra il coefficiente stechiometrico e posizionare un segno inferiore prima dell'equazione se si tratta di un reagente. Vale a dire:
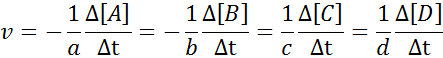
Esempio di definizione di velocità di reazione
Data la seguente reazione chimica:
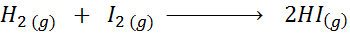
Scrivi la definizione della velocità di reazione a seconda di ciascuna specie coinvolta.
Soluzione:
In termini di H2:
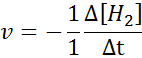
In termini di i2:
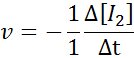
In termini di hi:
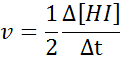
La legge sulla velocità e l'ordine di reazione
Le reazioni si verificano quando atomi e molecole si scontrano tra loro con energia sufficiente e un corretto orientamento. La probabilità che ciò accada aumenta quando atomi e molecole sono più concentrati.
Per questo motivo, la velocità dipende quasi sempre dalla concentrazione di reagenti. In alcuni casi, la velocità dipende anche dalla concentrazione di uno qualsiasi dei prodotti, nonché dalla concentrazione di qualsiasi catalizzatore o inibitore presente nell'ambiente.
L'equazione matematica che mette in relazione la velocità di una reazione alla concentrazione delle diverse specie coinvolte è chiamata "Speed Law"E, in casi più semplici, ha la seguente forma:
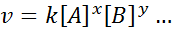
Dove K È una costante di proporzionalità chiamata costante di velocità, e gli esponenti di A, B e di qualsiasi altra specie che appare nell'equazione, sono chiamati ordini di reazione.
Secondo la somma di tutti gli ordini di reazione (che si chiama ordine globale), si possono distinguere diversi tipi di reazioni. Questi differiscono da quanto la concentrazione influisce sulla velocità, nella formula del tempo necessario per consumare metà dei reagenti (mezza vita) e nel modo in cui la concentrazione dei reagenti cambia nel tempo (i grafici [a] vs t ).
-
Reazioni dell'ordine 0
Quando tutti gli esponenti nella legge sulla velocità sono 0, l'equazione della legge di velocità è ridotta a:
Può servirti: collegamento covalente coordinato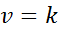
In altre parole, sono reazioni che si verificano a velocità costante e in cui la velocità non dipende dalla concentrazione di alcun reagente o prodotto.
Ordina grafici 0
Il grafico di [a] vs t delle reazioni dell'ordine 0 sono linee rette discendenti.
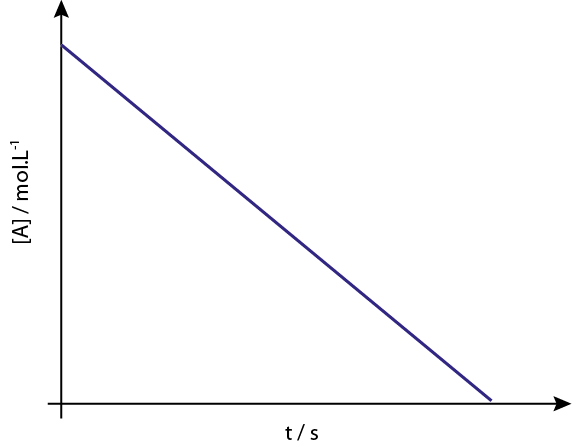
Legenda: il grafico di concentrazione vs tempo di una reazione dell'ordine 0 fornisce una linea retta.
Vita media per l'ordine 0
Per una reazione dell'ordine 0, il tempo di mezza vita (T1/2) È dato da:
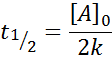
-
Reazioni del 1 ° ordine
In queste reazioni la velocità varia linearmente con la concentrazione. La legge sulla velocità del primo ordine è:
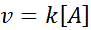
Grafica del primo ordine
Il grafico di [a] vs t delle reazioni di primo ordine sono iperboli discendenti. Tuttavia, se il logaritmo neperiano di concentrazione (ln [a]) vs tempo è grafico, si ottiene una linea retta.
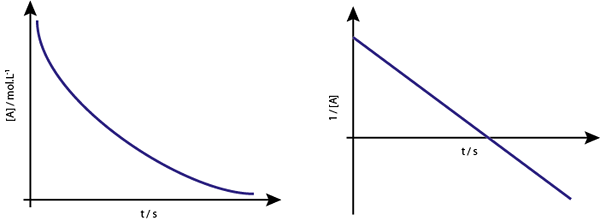 Il grafico di concentrazione rispetto al tempo di una reazione dell'ordine 1 fornisce un'iperbole, ma il grafico del logaritmo neperiano della concentrazione rispetto al tempo dà una linea
Il grafico di concentrazione rispetto al tempo di una reazione dell'ordine 1 fornisce un'iperbole, ma il grafico del logaritmo neperiano della concentrazione rispetto al tempo dà una linea Vita media per le reazioni del primo ordine
Per una reazione dell'ordine 1, T1/2 Non dipende dalla concentrazione iniziale ed è dato da:
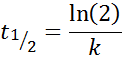
-
Reazioni del secondo ordine
Una reazione può essere il secondo ordine rispetto a un singolo reagente o del primo ordine rispetto a due reagenti. Nel primo caso, la legge di velocità è data da:
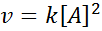
Grafica del secondo ordine
Il grafico di [a] vs t delle reazioni di secondo ordine sono iperboli discendenti. Tuttavia, se viene tracciato l'inverso della concentrazione (1/[a]) rispetto al tempo, si ottiene una linea retta.
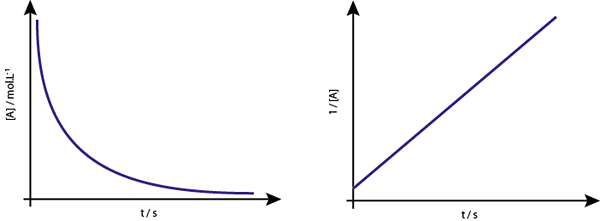 Il grafico della concentrazione rispetto al tempo di una reazione dell'ordine 2 fornisce una curva simile a un'iperbole discendente, ma il grafico della concentrazione vs. tempo fornisce una linea
Il grafico della concentrazione rispetto al tempo di una reazione dell'ordine 2 fornisce una curva simile a un'iperbole discendente, ma il grafico della concentrazione vs. tempo fornisce una linea Vita media per le reazioni del secondo ordine
Per una reazione dell'ordine 2, T1/2 È dato da:
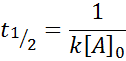
Fattori che influenzano la velocità di reazione
Temperatura
La temperatura aumenta sempre la velocità con cui si verificano le reazioni, poiché la frequenza e l'energia con cui le molecole si scontrano tra loro aumentano. La dipendenza dalla velocità di reazione con la temperatura è data dall'equazione di Arrhenius.
Può servirti: idruro di magnesio: struttura, proprietà e usiPressione
L'aumento della pressione è equivalente all'aumento della concentrazione di tutte le specie nel mezzo di reazione (per le reazioni della fase gassosa), quindi gli aumenti della pressione tendono ad aumentare la velocità delle reazioni.
Catalizzatori
I catalizzatori sono sostanze chimiche che vengono aggiunte al mezzo solo per aumentare la velocità di reazione. La maggior parte dei catalizzatori funziona modificando il meccanismo di reazione di uno che richiede un'energia di attivazione inferiore.
Esempi di catalizzatore comuni sono gli enzimi nei sistemi viventi e alcuni metalli come il platino e il paladio.
Inibitori
Gli inibitori sono l'opposto dei catalizzatori. Sono sostanze che rendono le reazioni più lentamente. Gli anticorrosivi sono esempi di inibitori che cercano di ridurre la velocità delle reazioni di corrosione, per rendere più le superfici metalliche.


