Fondazione, tecnica e usi della catalasi

- 1427
- 294
- Brigitta Ferrari
IL catalasi È una metodologia utilizzata nei laboratori di batteriologia per evidenziare la presenza di enzimi catalasi in quei batteri che la possiedono. Accanto alla colorazione di Gram ci sono i test principali che dovrebbero essere eseguiti su microrganismi appena isolati. Questi test guidano il microbiologo sui passaggi da seguire per l'identificazione definitiva del microrganismo in questione.
In generale, i batteri contenenti il citocromo hanno l'enzima di catlasi, cioè i batteri anaerobici aerobici e opzionali dovrebbero possederlo. Tuttavia, ci sono eccezioni, come lo streptococcus, che nonostante siano opzionali i microrganismi anaerobici non possiedono l'enzima della catalasi.
 Esecuzione del test della catalasi, che mostra una reazione positiva. Fonte: nessun autore leggibile da macchina fornita. NASE assunto (basato su reclami di copyright). [CC BY-SA 3.0 (http: // creativeCommons.Org/licenze/by-sa/3.0/]]
Esecuzione del test della catalasi, che mostra una reazione positiva. Fonte: nessun autore leggibile da macchina fornita. NASE assunto (basato su reclami di copyright). [CC BY-SA 3.0 (http: // creativeCommons.Org/licenze/by-sa/3.0/]] Questo è il motivo per cui il test della catalasi viene utilizzato principalmente per distinguere lo stafilococaee e le micrococaceae (entrambe la catalasi positiva) della famiglia Streptococaee (catalasi negativa) (catalasi negativa).
Allo stesso modo, il genere Bacillus (catalasi positiva) si distingue dal genere Clostridium (catalasi negativa), tra gli altri.
[TOC]
Base
La catalasi è un enzima classificato come idroperossidasi, ciò significa che usano il perossido di idrogeno come substrato (H2O2).
È anche considerato un'ossidoreduttasi, poiché nella reazione in cui esiste un elemento che funge da donatore di elettroni (riducendo la sostanza) e un altro come ricevitore di elettroni (sostanza ossidante).
La catalasi è una proteina che contiene un gruppo prostorico con quattro atomi di ferro trivalente (Faith+++), quindi è un omoproteina. Lo ione ferrico rimane ossidato durante la reazione.
Si può dire che la catalasi è un enzima disintossicante, poiché la sua funzione è quella di eliminare le sostanze che si verificano durante il metabolismo batterico che sono tossici per i batteri. Tra queste sostanze c'è il perossido di idrogeno.
Il perossido di idrogeno si forma dalla decomposizione degli zuccheri da parte dell'aerobica. Questo processo si verifica come segue:
Lo ione superossido (o2-) (Radicale libero) è formato come un prodotto finale dell'assimilazione del glucosio da parte di Aerobic Road. Questo è tossico ed è eliminato dall'enzima superossido dismutasi che lo trasforma in ossigeno gassoso e perossido di idrogeno.
Può servirti: Holdridge Life Zones: What Is in Latin AmericaIl perossido di idrogeno è anche tossico per i batteri e deve essere eliminato. L'enzima della catalasi sviluppa il perossido di idrogeno in acqua e ossigeno.
La catalasi può agire su altri substrati diversi dal perossido di idrogeno, come alcoli, aldeidi, acidi, ammine aromatiche e fenoli. Tuttavia, il perossido di idrogeno può anche essere utilizzato dalla catalasi per ossidare altri composti tossici come metil ed etil alcol.
Allo stesso modo, la catalasi è presente nelle cellule fagocitiche, proteggendola dall'azione tossica del perossido di idrogeno.
Tecnica di routine per il test della catalasi
-Metodo nella diapositiva
Materiali
3% di perossido di idrogeno (10 volumi).
Lamina portatile
Manico in plastica usa e getta o bastone di legno.
Procedura
Prendi abbastanza quantità dalla colonia per studiare senza toccare l'agar da cui proviene. La colonia deve essere fresca, cioè da un raccolto da 18 a 24 ore.
Posizionare la colonia sul supporto a secco e aggiungi una goccia di perossido di idrogeno al 3% (puoi anche usare H2O2 al 30%). Osservare immediatamente se le bolle vengono staccate o no.
Interpretazione
Reazione positiva: distacco di gas, che è evidente con la formazione di bolle (forte bolla).
Reazione negativa: non c'è formazione di bolle.
-Metodo diretto in pura cultura
Luogo 1 ml di H2O2 3% sulla coltura pura in piastre o zeppe che non contengono sangue (preferisce impugnatura nutriente). Osserva se c'è immediatamente la formazione di bolle. Puoi anche usare H2O2 30%.
È interpretato proprio come il metodo del supporto oggetto.
-Metodo con capillare o fung e tubo Petrishko
Riempi un tubo capillare da 67 mm ad un'altezza di 20 mm con perossido di idrogeno al 3% per capillarità.
Tocca la colonia isolata che vuoi studiare con il capillare pieno di H2O2 3%. Osserva se il capillare è pieno di bolle in circa 10 secondi. Questo metodo consente di semi-quantificare la reazione alle croci:
Senza croci non ci sono bolle (reazione negativa).
Può servirti: flora e fauna delle Isole Falkland: specie eccezionali+ --Bolle scarse (reazione debole o ritardata).
++ -Bolle abbondanti (reazione moderata).
+++ -Le bolle raggiungono l'estremità opposta (reazione energetica).
-Metodo Taylor e Achanzar per i test di catalasi che danno dubbi su
In una diapositiva pulita e asciutta posizionata una colonia isolata, quindi posiziona una goccia di H2O2 0,5% e copertura con una copertura. Osserva se esiste o meno una formazione di bolle imprigionate.
Interpretazione: la presenza di bolle indica una reazione positiva. Senza bolle, viene interpretato come una reazione negativa.
Test della catalasi per le specie Mycobacterium
Questa tecnica deve essere eseguita controllando il pH e la temperatura. Deve essere eseguito sotto una campana di flusso laminare, poiché la manipolazione delle diverse specie di Mycobacterium è pericolosa.
-Materiali
Perossido di idrogeno 30% o 110 volume (Superossal).
Tampone fosfato pH 7
Tween da 80 al 10%
Cultura di Mycobacterium in cuneo da 3 a 4 settimane
-Preparazione Di reagenti
Tampone fosfato pH 7
Pesare:
1.361 g di (KH2Po4) Anhydra.
1,420 g di (Na2HPO3) fosfato disodico anidro.
Sciogliere entrambi i sali in un po 'di acqua distillata sterile e completo di acqua fino a 1000 ml.
Tween da 80 al 10%
Esegui una diluizione 1:10 alla Tween 80 che viene concentrata commercialmente, per questo procedere come segue:
Prendi 1 ml di Tween 80 e posizionalo in un po 'di acqua distillata, dissolvi e quindi completa il volume con acqua fino a 10 ml.
Reagente finale
Mescola una quantità di tampone fosfato con una quantità di tween da 80 al 10% (in parti uguali). Definisci in laboratorio quanto vuoi preparare.
-Procedura
Posizionare 5 ml di tampone fosfato in un tubo di prova sterile con coperchio filo (Baquelita).
Con una maniglia di inoculazione, prendi abbastanza colonia di una crescita di Mycobacterium seminata in zeppe e dissolvi nel tampone fosfato.
Coprire il tubo senza serrare il filo. Mettere in bagno a 68 ° C per 20-30 minuti. Elimina e raffreddare a 22-25 ° C
Misurare 0,5 ml del reagente finale (miscela) e aggiungerlo al tubo con la soluzione fredda. Osservare o non la formazione di bolle.
È interpretato così come le tecniche precedenti.
Utilizzo
Quando si ottiene una crescita delle colonie nei media arricchiti, una colorazione Gram e un test di catalasi devono essere eseguiti nelle colonie ottenute. Ciò guiderà il microbiologo sulle procedure da seguire per l'identificazione definitiva.
Può servirti: semplice epitelio piatto: caratteristiche, funzioni e tipi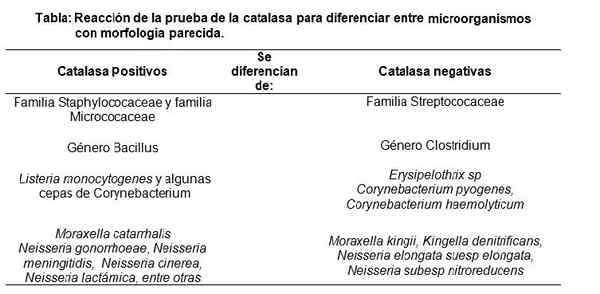 Fonte: preparato dall'autore MSC. Marielsa Gil
Fonte: preparato dall'autore MSC. Marielsa Gil QA
Per valutare il corretto funzionamento del reagente di perossido di idrogeno, utilizzare controlli appena coltivati, come Staphylococcus aureus come controllo positivo e ceppi di Streptococcus sp come controllo negativo.
Un'altra alternativa che funge da controllo positivo è quella di posizionare una goccia di perossido di idrogeno sull'agar nel sangue, gli eritrociti hanno catalasi, quindi ci sarà un gorgogliamento se il reagente è in buone condizioni.
Puoi usare un agar al cioccolato come controllo negativo, qui gli eritrociti sono già elencati e il test fornisce negativo.
Limitazioni
-Non usare vecchie colture per il test, in quanto ciò può causare falsi negativi.
-Evita di prendere le colonie dalle colture nell'agar del sangue, se stai attento a non toccare l'agar; Questa procedura può causare falsi positivi, poiché gli eritrociti contengono catalasi.
-Se prendi la colonia con impugnatura platino, non investire l'ordine della procedura perché questo può generare falsi positivi. Questo perché il platino è in grado di reagire con il perossido di idrogeno, originando una bolla.
-Non utilizzare il reagente per perossido di idrogeno se è molto vecchio, poiché il reagente è molto instabile e tende a rompersi nel tempo.
-Mantenere il reagente di perossido di idrogeno protetto dalla luce e dalla refrigerazione per prevenire il danno.
-Eseguire il controllo di qualità sul reagente per il perossido di idrogeno ogni volta che viene utilizzato.
-Tenere conto che se H viene utilizzato2O2 Al 30% le reazioni sono più forti di quelle eseguite con H2O2 3%.
Riferimenti
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnosi microbiologica. 5 ° ed. Pan -American Editoriale S.A. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnosi microbiologica di Bailey e Scott. 12 ed. Pan -American Editoriale S.A. Argentina.
- Mac Faddin J. (2003). Test biochimici per l'identificazione dei batteri dell'importanza clinica. 3a ed. PAN -American Editoriale. Buenos Aires. Argentina.
- Laboratori BD. Reagente della catalasi. Disponibile su: http: // winklerltda.Cl
- Laboratori Vadequímica. Perossido di idrogeno. Equivalenza tra volumi e percentuale. Disponibile su: Vadequimica.com

