Proprietà periodiche degli elementi e delle loro caratteristiche

- 3342
- 873
- Baldassarre Ross
IL Proprietà periodiche degli elementi Sono quelli che definiscono il loro comportamento fisico e chimico da una prospettiva atomica e le cui magnitudini, oltre al numero atomico, consentono una classificazione degli atomi.
Di tutte le proprietà, queste sono caratterizzate, come suggerisce il nome, perché sono periodiche; Cioè, se viene studiata la tavola periodica, si può certificare che le sue magnitudini obbediscono a una tendenza che coincide e si ripete con l'ordinamento degli elementi in periodi (righe) e gruppi (colonne).
 Periodicità intrinseca di una parte degli elementi della tavola periodica. Fonte: Gabriel Bolívar.
Periodicità intrinseca di una parte degli elementi della tavola periodica. Fonte: Gabriel Bolívar. Ad esempio, se si viaggia un periodo periodico e la proprietà diminuisce con grandezza con ciascun elemento, lo stesso avverrà in tutti i periodi. D'altra parte, se scendendo un gruppo o una colonna, aumenta la sua grandezza, lo stesso può essere prevedibile per gli altri gruppi.
E quindi, le loro variazioni vengono ripetute e evidenziate una semplice tendenza che concorda con l'ordinamento degli elementi per i loro numeri atomici. Queste proprietà sono direttamente responsabili della natura metallica o non metallica degli elementi, nonché delle loro reattività, che hanno contribuito a classificarli con una maggiore profondità.
Se per un momento l'identità degli elementi era sconosciuta e venivano viste come strane "sfere", la tavola periodica poteva essere ricostruita (con molto lavoro) che utilizzava queste proprietà.
In questo modo, le presunte sfere acquisirebbero colori che avrebbero permesso loro di differenziarli l'uno dall'altro in gruppi (immagine superiore). Conoscere le loro caratteristiche elettroniche, potrebbero organizzarsi in periodi e i gruppi tradirebbero quelli che hanno lo stesso numero di elettroni di valenza.
Le proprietà periodiche di apprendimento e ragionamento sono uguali a sapere perché gli elementi reagiscono in un modo o nell'altro; È sapere perché gli elementi metallici sono in alcune regioni del tavolo e gli elementi non metallici in un altro.
[TOC]
Quali sono le proprietà periodiche e le loro caratteristiche
-Radio atomica
Quando si osservano l'immagine sfrena la prima cosa che si può notare è che non tutte hanno le stesse dimensioni. Alcuni sono più voluminosi di altri. Se osservato con maggiori dettagli, si scoprirà che queste dimensioni variano a obbedire a uno schema: in un periodo diminuisce da sinistra a destra e in un gruppo aumenta dall'alto verso il basso.
Quanto sopra può anche essere detto in questo modo: il raggio atomico diminuisce verso i gruppi o le colonne di destra e aumenta nei periodi o nelle file inferiori. Pertanto, il raggio atomico è la prima proprietà periodica, poiché le sue variazioni seguono uno schema all'interno degli elementi.
Carica nucleare contro elettroni
Cos'è questo modello? In un periodo gli elettroni atomi occupano lo stesso livello di energia, che è correlato alla distanza che li separa dal nucleo. Quando passiamo da un gruppo all'altro (che è uguale a viaggiare nel periodo a destra), il nucleo aggiunge sia elettroni che protoni all'interno dello stesso livello di energia.
Può servirti: carbonioPertanto, gli elettroni non possono occupare distanze più lontano dal nucleo, il che aumenta il suo carico positivo perché ha più protoni. Di conseguenza, gli elettroni sperimentano una maggiore forza di attrazione verso il nucleo, attirandoli sempre più all'aumentare del numero di protoni.
Ecco perché gli elementi all'estremità destra della tabella periodica (colonne gialle e turchese) hanno radio atomiche più piccole.
D'altra parte, quando "salta" da un periodo all'altro (che è lo stesso per dire che un gruppo è disceso), i nuovi livelli di energia abilitati consentono agli elettroni di occupare spazi più distanti nel nucleo. Essendo ulteriormente, il nucleo (con più protoni) li attira con meno forza; E quindi le radio atomiche aumentano.
Radio ioniche
Le radio ioniche obbediscono a uno schema simile a quello delle radio atomiche; Tuttavia, questi non dipendono così tanto dal nucleo, ma quanti elettroni o meno hanno l'atomo rispetto al suo stato neutro.
Cationi (na+, AC2+, Al3+, Essere2+, Fede3+) mostrano un carico positivo perché hanno perso uno o più elettroni, e quindi il nucleo li attira con una forza maggiore poiché ci sono meno repulsioni tra di loro. Il risultato: i cationi sono più piccoli degli atomi da cui derivano.
E per gli anioni (o2-, F-, S2-, Yo-) Al contrario, mostrano un carico negativo perché ha uno o più elettroni in eccesso, aumentando le sue repulsioni tra loro sopra l'attrazione che il nucleo esercita. Il risultato: gli anioni sono più grandi degli atomi da cui derivano (immagine inferiore).
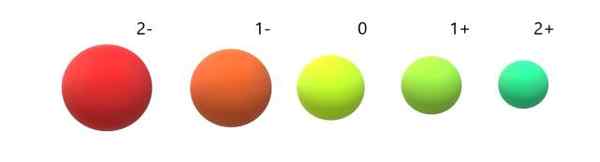 Variazione delle radio ioniche rispetto all'atomo neutro. Fonte: Gabriel Bolívar.
Variazione delle radio ioniche rispetto all'atomo neutro. Fonte: Gabriel Bolívar. Si può vedere che l'anione 2- è il più voluminoso di tutti, e il catione 2+ il più piccolo. Le radio aumentano quando l'atomo viene addebitato negativamente e si contrae quando viene addebitato positivamente.
-Elettronegatività
Quando gli elementi hanno piccole radio atomiche, non solo i loro elettroni sono attratti notevolmente, ma anche gli elettroni degli atomi vicini quando forma un legame chimico. Questa tendenza ad attirare gli elettroni di altri atomi all'interno di un composto è ciò che è noto come elettronegatività.
Quello che un atomo è piccolo non significa che sarà più elettronegativo. In tal caso, gli elementi di elio e idrogeno sarebbero gli atomi più elettronegativi. L'elio dove ha dimostrato la scienza, non forma un legame covalente di alcun tipo; E idrogeno, ha a malapena un singolo protone nel nucleo.
Può servirti: solfuro di rame: struttura, proprietà, usiQuando le radio atomiche sono grandi, i nuclei non hanno abbastanza resistenza per attirare gli elettroni di altri atomi; Pertanto, gli elementi più elettronegativi sono quelli con un piccolo raggio atomico e un numero maggiore di protoni.
Ancora una volta, coloro che incontrano perfettamente queste caratteristiche sono gli elementi non metallici del blocco P della tavola periodica; Questi sono quelli appartenenti al gruppo 16 o all'ossigeno (O, S, SE, TE, PO) e Gruppo 17 o Fluoro (F, Cl, Br, I, At).
Tendenza
Secondo tutto, gli elementi più elettronegativi si trovano particolarmente nell'angolo in alto a destra della tavola periodica; Avere fluoruro come elemento che conduce l'elenco dei più elettronegativi.
Perché? Senza ricorrere alle scale di elettronegatività (Pauling, Mulliken, ecc.), il fluoro sebbene sia più grande del neon (il gas nobile del suo periodo), il primo può formare collegamenti mentre il secondo non lo fa. Inoltre, per le sue piccole dimensioni il suo nucleo ha molti protoni e dove si trova il fluor.
-Carattere metallico
Se un elemento ha un raggio atomico rispetto a quelli dello stesso periodo, ed è anche poco elettronegativo, è allora un metallo e ha un carattere metallico elevato.
Se torniamo all'immagine principale, le sfere rossastri e verdastre, così come il grigio, corrispondono agli elementi metallici. I metalli hanno caratteristiche uniche e da qui le proprietà periodiche con le proprietà fisiche e macroscopiche della materia iniziano a essere intrecciate.
Gli elementi con un alto carattere metallico sono caratterizzati dai loro atomi relativamente grandi, facili da perdere elettroni poiché i nuclei possono appena attirarli verso di loro.
Di conseguenza, ossidano o perdono facilmente elettroni per formare cationi, m+; Ciò non significa che tutti i cationi siano metallici.
Tendenza
A questo punto puoi prevedere come varia il carattere metallico nella tabella periodica. Se è noto che i metalli hanno grandi radio metalliche e che ci sono anche pochi elettronegativi, gli elementi più pesanti (periodi più bassi) dovrebbero essere previsti, essere i più metallici; e gli elementi più leggeri (i periodi superiori), il meno metallico.
Allo stesso modo, il carattere metallico diminuisce, più elettronegativo viene realizzato l'elemento. Ciò significa che visitare i periodi e i gruppi a destra della tavola periodica, nei loro periodi più alti, soddisferà gli elementi meno metallici.
Pertanto, il carattere metallico aumenta scendendo da un gruppo e diminuisce a destra a destra nello stesso periodo. Tra gli elementi metallici che abbiamo: Na (sodio), Li (litio), mg (magnesio), ba (bario), AG (argento), AU (oro), PO (polonio), PB (piombo), CD (cadmio ), A (alluminio), ecc.
Può servirti: punto di ebollizione: concetto, calcolo ed esempi-Energia ionizzata
Se un atomo ha un grande raggio atomico, si prevede che il suo nucleo non mantenga gli elettroni in notevole resistenza negli strati più esterni. Di conseguenza, eliminarli dall'atomo in una fase gassosa (individualizzata) non richiederà molta energia; Questa è, l'energia di ionizzazione, EI, necessaria per togliere un elettrone.
Anche gli uguali a dire che è l'energia che deve essere fornita per superare la forza di attrazione del nucleo di un atomo o un gas ione sul suo elettrone più esterno. Più piccolo è l'atomo e più elettronegativo, più basso è; Questa è la tua tendenza.
La seguente equazione illustra un esempio:
Na (g) => na+(g) + e-
Il necessario per raggiungere questo obiettivo non è così grande rispetto alla seconda ionizzazione:
N / a+(g) => na2+(g) + e-
Da quando in na+ Le cariche positive predominano e lo ione è più piccolo dell'atomo neutro. Di conseguenza, il nucleo di NA+ attira con una forza molto maggiore per gli elettroni, quindi richiede uno molto più grande.
-Affinità elettronica
E infine, c'è la proprietà periodica dell'affinità elettronica. Questa è la tendenza energetica che ha l'atomo di un elemento di fase gassosa per accettare un elettrone. Se l'atomo è piccolo e ha un nucleo con una grande forza di attrazione, sarà facile accettare l'elettrone, formando un anione stabile.
Più stabile è l'anione rispetto al suo atomo neutro, maggiore è la sua affinità elettronica. Tuttavia, entrano in gioco le repulsioni tra gli stessi elettroni.
L'azoto, ad esempio, ha una maggiore affinità elettronica dell'ossigeno. Questo perché i loro tre elettroni 2P sono scomparsi e respingono meno tra loro e elettrone in arrivo; Mentre nell'ossigeno, ci sono una coppia di elettroni accoppiati che esercitano una maggiore repulsione elettronica; E nel fluoro, ci sono due coppie.
È per questo motivo che si dice che la tendenza nelle affinità elettroniche sia normalizzata dal terzo periodo della tabella periodica.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Prof. Ortega graciela m. (1 aprile 2014). Proprietà periodiche degli elementi. Colore ABC. Estratto da: ABC.com.Py
- Chimica librettexts. (7 giugno 2017). Proprietà del periodo degli elementi. Recuperato da: Chem.Librettexts.org
- Helmestine, Anne Marie, PH.D. (2 gennaio 2019). Le proprietà periodiche degli elementi. Recuperato da: Thoughtco.com
- Toppr. (S.F.). Proprietà del periodo degli elementi. Recuperato da: toppr.com /
- Proprietà periodiche degli elementi: un viaggio attraverso il tavolo è un viaggio attraverso la chimica. [PDF]. Recuperato da: COD.Edu
- « Obsolescenza percepiti fattori, conseguenze ed esempi
- Storia dell'arte oggettivamente, caratteristiche, rappresentanti e opere »

