Processi termodinamici
- 1594
- 30
- Lino Lombardi
Spieghiamo quali sono i processi termodinamici, i tipi che esistono e forniscono diversi esempi
Quali sono i processi termodinamici?
IL Processi termodinamici Sono processi in cui un sistema termodinamico in studio subisce un cambiamento di stato. Durante questo cambiamento di stato, un movimento energetico si verifica all'interno del sistema o tra il sistema. In effetti, questo è il motivo per cui vengono chiamati Processi termodinamici, dato che Thermos- Si riferisce al calore (una forma di energia) e -dinamico Si riferisce al movimento.
Per cambio di stato, non viene necessariamente definito dal fluido solido a fluido o gas non viene fatto (sebbene quelli siano anche processi termodinamici), ma a un cambiamento nelle funzioni statali, cioè nelle variabili che definiscono lo stato del stato di sistema come temperatura, volume e pressione.
I processi termodinamici si verificano ovunque. In effetti, praticamente qualsiasi processo di modifica per il quale un sistema può essere definito può essere considerato un processo termodinamico. Da un gelato che si scioglie al funzionamento di un motore a combustione interna o al funzionamento di un frullatore.
Tipi di processi termodinamici
Esistono un'ampia varietà di processi termodinamici, quindi è necessario classificarli per facilitare il loro studio. I criteri principali per classificare i processi termodinamici sono:
- Secondo il tasso di cambio nel sistema
- Secondo la funzione statale che rimane costante
- Secondo la seconda legge della termodinamica
1. Tipi di processi termodinamici in base al tasso di cambio
-
Cambiamenti del sistema
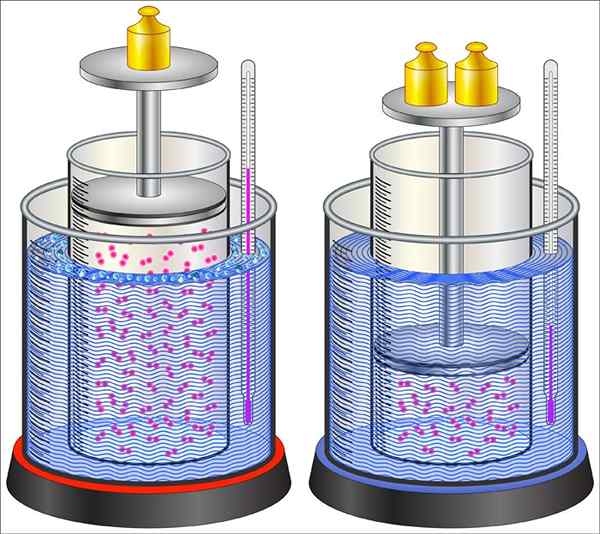
Questo tipo di processo termodinamico è caratterizzato dal passaggio del sistema da uno stato iniziale a uno finale, entrambi definiti da un numero adeguato di variabili di stato. In questo tipo di processi, il sistema è in equilibrio termodinamico sia nello stato iniziale che nello stato finale e la modifica è causata da un agente esterno.
Può servirti: Pithi Box: caratteristica, funzioni, usa esempi Esempio del processo di cambiamento nel sistema, in questo caso si verifica un cambiamento di stato nel gas all'interno del cilindro
Esempio del processo di cambiamento nel sistema, in questo caso si verifica un cambiamento di stato nel gas all'interno del cilindro L'equilibrio termodinamico è una condizione macroscopica, il che implica che il sistema non subirà alcun cambiamento nel tempo a meno che non sia disturbato da una forza esterna. Ciò può consistere nel contributo dell'energia sotto forma di calore, lavoro, tra gli altri.
Va notato che, quando si studiano processi di cambiamento nel sistema, molte volte (sebbene non sempre) il processo stesso non è importante ma solo lo stato iniziale e lo stato finale.
-
Processi ciclici
In molte situazioni, in particolare nella costruzione di macchine basate su processi termodinamici, il sistema viene sottoposto a una serie di processi di modifica dello stato che iniziano da uno stato iniziale, passano attraverso una serie di stati intermedi e termina di nuovo nello stesso stato iniziale originale, iniziale originale, Così completando un ciclo.
 I processi all'interno del cilindro di un motore a combustione interna sono processi ciclici, che vengono continuamente ripetuti per far funzionare il motore
I processi all'interno del cilindro di un motore a combustione interna sono processi ciclici, che vengono continuamente ripetuti per far funzionare il motore I processi ciclici non producono un cambiamento netto nello stato del sistema (poiché iniziano e finiscono nello stesso stato), ma a seconda di come viene eseguito il ciclo, possono produrre il trasferimento di energia netto da una parte dell'ambiente circostante un altro o tra altri due sistemi separati.
Un esempio di processi ciclici è ciò che accade all'interno dei pistoni di un motore a combustione interna, nonché l'insieme di processi che si verificano all'interno del compressore dei sistemi di raffreddamento.
-
Processi di flusso
I processi di flusso differiscono dagli altri due tipi di processi, in cui il sistema è costituito dalla questione che si trova in un determinato momento all'interno di un contenitore attraverso il quale passa un flusso costante di materia.
Può servirti: glicole etilenico: proprietà, struttura chimica, usi Tubi in una fabbrica in cui si verificano processi di flusso
Tubi in una fabbrica in cui si verificano processi di flusso Questi tipi di processi termodinamici sono comunemente usati nell'ingegneria e le proprietà di interesse sono, in generale, i tassi di ingresso energetico e di uscita da e verso il contenitore come è attraversato dalla questione che può essere un liquido puro, una soluzione, a miscela reagente, ecc.
2. Tipi di processi termodinamici secondo la funzione di stato che rimane costante
Per facilitare la loro analisi e interpretazione, vengono eseguiti molti processi termodinamici mantenendo una o più variabili costanti. In questo modo, possono essere determinati gli effetti sul sistema di cambiamento di un piccolo numero di variabili. Ciò rende diversi tipi di sistemi termodinamici possono essere definiti in base alla variabile che rimane costante. Questi sono:
-
Processi isotermici (T = CTTE)
Sono quei processi in cui la temperatura rimane costante. Nonostante non sembra intuitivo, il fatto che la temperatura non cambi non significa che non vi sia trasferimento di calore. Durante questi processi non vi è alcun cambiamento nell'energia interna del sistema.
-
Processi isocorici (v = CTTE)
Sono i processi che si verificano senza cambio di volume. In generale, si verificano in sistemi chiusi con pareti rigide (che non possono essere deformanti). Sono anche chiamati isovolumetrici e isometrici. Sono caratterizzati dal non coinvolgere il lavoro di espansione p-v.
-
Processi isobarici (P = CTTE)
È forse il tipo più comune di processo termodinamico con cui ci siamo imbattuti nella nostra vita quotidiana. Sono caratterizzati da una costante pressione.
-
Processi adiabatici (Q = 0)
Questi sono i processi che si verificano senza alcun trasferimento di calore. Di solito sono confusi con i processi isotermici poiché, poiché non ci sono trasferimenti di calore, molti presumono che non vi sia alcun cambiamento di temperatura. Tuttavia, non è così.
-
Processi isoentropici (S = CTTE)
Sono processi in cui l'entropia del sistema rimane costante.
-
Processi isoalentalpic (H = CTTE)
Sono quei processi in cui l'entalpia del sistema rimane costante.
Può servirti: tiosolfato di sodio (Na2S2O3)3. Tipi di processi termodinamici secondo la seconda legge della termodinamica
La seconda legge viene utilizzata per prevedere la spontaneità dei processi termodinamici. Sulla base di ciò, si possono distinguere i seguenti tipi di processi:
-
Processi spontanei
Sono quelli che implicano un aumento dell'entropia dell'universo e, quindi, si verificano spontaneamente (naturalmente).
-
Processi reversibili
Questo tipo di processi non comporta il cambiamento nell'entropia dell'universo e, pertanto, è in equilibrio. Sono processi reversibili che possono verificarsi in entrambe le direzioni.
-
Processi irreversibili
Sono quelli che implicano una diminuzione dell'entropia dell'universo e, quindi, non si verificano naturalmente dallo stato iniziale alla fine, ma nella direzione opposta.
Esempi di processi termodinamici
- Il ciclo di Carnot è un Processo ciclico di 4 fasi, su cui si basano sistemi di refrigerazione come i riferimenti.
- L'evaporazione di una pozza d'acqua è un esempio di a processo termodinamico irreversibile.
- La formazione di gelo in un congelatore è un Processo irreversibile.
- Il raffreddamento di un gas che viene pressurizzato lasciandolo sfuggire alla bottiglia è un esempio di un Processo adiabatico approssimativamente.
- La combustione del gas da cucina si verifica nell'aria a costante pressione atmosferica, quindi è considerata a processo isobarico.
- Il riscaldamento dell'acqua in un riscaldatore a gas è un Processo di flusso, Poiché l'acqua entra e lascia il tubo a una velocità costante, assorbendo il calore dalla combustione del gas.

