Formule di processo isobarico, equazioni, esperimenti, esercizi

- 3064
- 1
- Lino Lombardi
In un processo isobarico, la pressione P di un sistema rimane costante. Il prefisso "ISO" proviene dal greco e viene usato per indicare che qualcosa rimane costante, mentre "Baros", anche dal greco, significa peso.
I processi isobarici sono molto propri sia in contenitori chiusi che in spazi aperti, essendo semplici da individuarli in natura. Con questo intendiamo che sono possibili cambiamenti fisici e chimici sulla superficie terrena o sulle reazioni chimiche in contenitori aperti all'atmosfera.
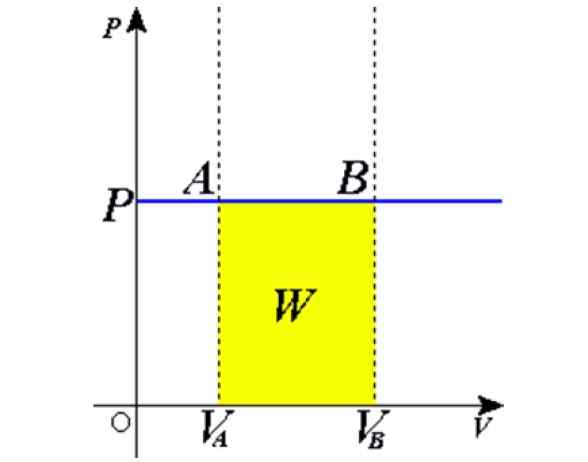 Figura 1. Processo isobarico: la linea orizzontale blu è un isobara, che significa costante pressione. Fonte: Wikimedia Commons.
Figura 1. Processo isobarico: la linea orizzontale blu è un isobara, che significa costante pressione. Fonte: Wikimedia Commons. Alcuni esempi si ottengono riscaldando al sole un palloncino pieno di aria, cucina, bolle o congelamento dell'acqua, il vapore che viene generato nelle caldaie o il processo di allevamento di una mongolfiera a base di aria calda. Più tardi daremo una spiegazione di questi casi.
[TOC]
Formula ed equazioni
Deriviamo un'equazione per il processo isobarico supponendo che il sistema in studio sia un gas ideale, un modello abbastanza adatto per quasi tutti i gas a meno di 3 atmosfere di pressione. Le particelle di gas ideali si muovono in modo casuale, occupano l'intero volume dello spazio che li contiene senza interagire tra loro.
Se il gas ideale bloccato in un cilindro dotato di un pistone mobile può espandersi lentamente, si può presumere che in ogni momento le sue particelle sono in equilibrio. Quindi il gas esercita sul pistone dell'area A una forza F Magnitudine:
F = p.A
Dove P È la pressione del gas. Questa forza esercita un lavoro che produce uno spostamento infinitesimale Dx Nel pistone dato da:
dw = fdx = pa.Dx
Come il prodotto ADX È un differenziale di volume Dv, COSÌ Dw = pdv. Resta da integrare entrambi i lati dal volume iniziale VA Fino al volume finale VB Per ottenere il lavoro totale svolto dal gas:


[TOC]
Esperimenti
La situazione descritta viene verificata sperimentalmente configurazione di un gas all'interno di un cilindro fornito con un pistone mobile, come mostrato nelle figure 2 e 3. Un pistone è posizionato sul pistone, il cui peso è diretto verso il basso, mentre il gas esercita una forza grazie alla pressione P che produce sul pistone.
Può servirti: imantation: cosa consiste, metodo ed esempi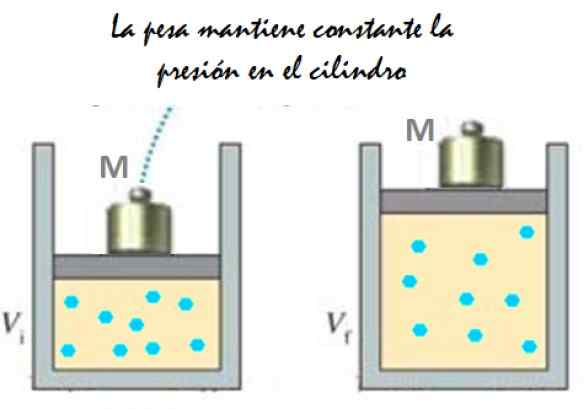 figura 2. Sperimenta che consiste nell'espansione di un gas a pressione costante. Fonte: f. Zapata.
figura 2. Sperimenta che consiste nell'espansione di un gas a pressione costante. Fonte: f. Zapata. Poiché il pistone è in grado di muoversi liberamente, il volume che il gas occupa può cambiare senza problemi, ma la pressione rimane costante. Aggiunta di pressione atmosferica PATM, che esercita anche una forza verso il basso, hai:
Mg - p.A + pATM . A = costante
Pertanto: p = (mg/a) + pATM Non varia, a meno che M e con esso il peso non sia modificato. Aggiungendo calore al cilindro, il gas si espanderà aumentando il suo volume o si contraggerà quando si estrae calore.
Processi isobarici nel gas ideale
L'equazione dello stato del gas ideale riguarda le variabili di importanza: pressione P, volume V e temperatura T:
P.V = n .R.T
Qui n rappresenta il numero di moli e R è la costante dei gas ideali (validi per tutti i gas), che viene calcolato moltiplicando la costante di Boltzmann per il numero di Avogadro, risultando
R = 8.31 J/mol K
Quando la pressione è costante, l'equazione statale può essere scritta come:
V/t = nr/p
Ma NR/P è costante, poiché N, R e P sono. Quindi, quando il sistema passa da uno stato 1 a un altro stato 2, sorge la seguente proporzione, nota anche come legge di Charles:
V1/T1 = V2/T2
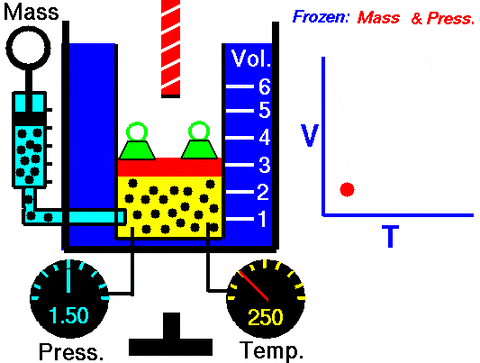 Figura 3. Animazione che mostra l'espansione di gas a pressione costante. A destra il grafico del volume a seconda della temperatura, che è una linea. Fonte: Wikimedia Commons. Glenn Research Center della NASA [dominio pubblico].
Figura 3. Animazione che mostra l'espansione di gas a pressione costante. A destra il grafico del volume a seconda della temperatura, che è una linea. Fonte: Wikimedia Commons. Glenn Research Center della NASA [dominio pubblico]. Sostituire W = PΔV, Il lavoro svolto per passare dallo stato 1 a 2, in termini di costanti e variazione di temperatura, facile da misurare con un termometro:
W1 → 2 = nr (t2 - T1) = nr.Δt
D'altra parte, la prima legge della termodinamica lo stabilisce:
∆U = Q - W
Ciò significa che aggiungendo al gas una certa quantità di calore q, l'energia interna ∆U aumenta e le vibrazioni delle sue molecole aumentano. In questo modo, il gas si espande ed svolge lavoro spostando il pistone, come abbiamo detto prima.
In un gas monoatomico ideale e la variazione dell'energia interna ∆U, che include sia l'energia cinetica che l'energia potenziale delle sue molecole, è:
∆U = (3/2)Nr Δt
Finalmente ci combiniamo in una delle espressioni che abbiamo ottenuto:
Q = ∆U + W = (3/2)Nr Δt + Nr∆t = (5/2) Nr Δt
In alternativa che può essere riscritto in termini di massa M, la differenza di temperatura e una nuova costante chiamata Calore di calore specifico A costante pressione, abbreviato CP, le cui unità sono J/mol K:
Può servirti: Venere (pianeta)Q = M CP ∆t
Esempi
Non tutti i processi isobarici vengono eseguiti in contenitori chiusi. In effetti, si verificano innumerevoli processi termodinamici di tutti i tipi di pressione atmosferica, quindi i processi isobarici sono molto frequenti in natura. Ciò include cambiamenti fisici e chimici sulla superficie terrestre, reazioni chimiche in contenitori aperti e molto altro.
Affinché si verifichino processi isobarici in sistemi chiusi, è necessario che i loro bordi siano abbastanza flessibili da consentire le variazioni di volume senza la pressione variata.
Questo era quello che è successo nell'esperimento del pistone che si muoveva facilmente quando il gas si espanse. Lo stesso accade racchiudendo un gas in una festa per feste o una mongolfiera.
Qui abbiamo diversi esempi di processi isobarici:
Fai bollire l'acqua e cuocere
L'acqua bollente per il tè o le salse di cottura in contenitori aperti sono buoni esempi di processi isobarici, poiché tutti si sviluppano a pressione atmosferica.
Quando si riscaldano l'acqua, la temperatura e il volume aumentano e se il calore viene continuato, viene finalmente raggiunto il punto di ebollizione, in cui si verifica il cambiamento della fase idrica. Mentre ciò si verifica, la temperatura rimane anche costante di 100 º C.
Freeze Water
D'altra parte, l'acqua di congelamento è anche un processo isobarico, sia che si svolga in un lago durante l'inverno o il frigorifero domestico.
Scalda un palloncino pieno d'aria al sole
Un altro esempio del processo isobarico è la variazione del volume di un palloncino gonfiato d'aria quando viene lasciato esposto al sole. Prima cosa al mattino, quando non fa molto caldo, il globo ha un certo volume.
Col passare del tempo e la temperatura aumenta, anche il globo riscalda aumentando il suo volume e tutto ciò accade sotto costante pressione. Il materiale del globo è un buon esempio di bordo abbastanza flessibile da rendere l'aria all'interno, quando riscaldato, si espande senza modificare la pressione.
L'esperienza può anche essere effettuata regolando il globo senza inflar nel picco di una bottiglia di vetro piena con un terzo dell'acqua, che viene riscaldata a Maria Bio di Maria. Non appena l'acqua viene riscaldata, il palloncino viene gonfiato immediatamente, ma si dovrebbe fare attenzione a non riscaldare troppo in modo da non esplodere.
Il palloncino aerostatico
È una nave galleggiante senza propulsione, che utilizza correnti d'aria per trasportare persone e oggetti. Il globo è solitamente pieno di aria calda, che è più fredda dell'aria circostante, si alza e si espande rendendo il globo ruvido.
Può servirti: triplo puntoMentre le correnti d'aria si dirigono verso il globo, ha bruciatori che vengono attivati per riscaldare il gas quando si desidera ascendere o mantenere l'altezza e sono disattivate quando si discostano o l'atterraggio. Tutto ciò accade a pressione atmosferica, supposto costante ad una certa altezza non lontano dalla superficie.
 Figura 4. Mongolfiera. Fonte: Pixabay.
Figura 4. Mongolfiera. Fonte: Pixabay. Caldaie
Nelle caldaie, il vapore viene generato riscaldando l'acqua e mantenendo la pressione costante. Quindi questo vapore fa un lavoro utilizzabile, ad esempio generando elettricità nelle piante termoelettriche o agendo altri meccanismi come locomotive e pompe d'acqua.
Esercizi risolti
Esercizio 1
Ci sono 40 litri di gas a 27 ° C temperatura. Trova l'aumento del volume quando si aggiunge il calore isobáricamente fino a raggiungere 100 ºC.
Soluzione
La legge di Charles viene utilizzata per determinare il volume finale, ma l'attenzione: le temperature devono essere espresse in Kelvin, basta aggiungere 273 K a ciascuno:
27 ºC = 27 + 273 K = 300 K
100 ºC = 100 + 273 K = 373 K
Da:
V1/T1 = V2/T2 ⇒ v2 = T2(V1/T1) = 373 ºC (40 l/300 K) = 49.7 l
Finalmente l'aumento del volume è V2 - V1 = 49.7 L - 40 L = 9.7 l.
Esercizio 2
5 sono forniti 5.00 x 103 J dall'energia a un gas ideale per fare 2.00 x 103 J di lavoro sul tuo ambiente in un processo isobarico. Viene chiesto di trovare:
a) Il cambiamento nell'energia interna del gas.
b) la variazione del volume, se ora l'energia interna diminuisce di 4.50 x 103 J e 7 sono espulsi.50 x 103 J del sistema, considerando una pressione costante di 1.01 x 105 papà.
Soluzione a
Usato ∆U = Q - W e i valori indicati nell'istruzione vengono sostituiti: Q = 5.00 x 103 J e W = 2.00 x 103 J:
=5.00 x 103 J - 2.00 x 103 J = 3.00 x 103 J
Pertanto l'energia interna del gas aumenta di 3.00 x 103 J.
Soluzione b
La variazione del volume si trova nel lavoro svolto: W = p∆v:
∆U = Q - W = Q - P∆v
L'affermazione afferma che l'energia interna diminuisce, quindi: ∆U= -4.50 x 103 J. Ci dice anche che una certa quantità di calore viene espulsa: Q = -7.50 x 103 J. In entrambi i casi, il segno negativo rappresenta una diminuzione e la perdita, quindi:
-4.50 x 103 J = -7.50 x 103 J - P∆V
Dove P = 1.01 x 105 papà. Poiché tutte le unità sono nel sistema internazionale, la modifica del volume è chiara:
∆V = (-4.50 x 103 J +7.50 x 103 J)/ (- 1.01 x 105 papà) = -2.97 X 10-2 M3
Poiché la variazione del volume è negativa, significa che il volume è diminuito, ovvero il sistema ha contratto.
Riferimenti
- Byjou's. Processo isobarico. Recuperato da: byjus.com.
- Cengel, e. 2012. Termodinamica. 7a edizione. McGraw Hill.
- Processo XYZ. Ulteriori informazioni sul processo isobarico. Recuperato da: 10process.X e z.
- Serway, r., Vulle, c. 2011. Fondamenti di fisica. 9na ed. Apprendimento del Cengage.
- Wikipedia. Leggi sul gas. Recuperato da: è.Wikipedia.org.

