Fondamenti di potenziometria, equazioni, elettrodi

- 1671
- 415
- Benedetta Rinaldi
IL Potenziometria È una tecnica di analisi elettrochimica che si basa sulla misurazione della tensione, di un mezzo o di un compartimento, con cui è determinata l'attività o la concentrazione di una specie (ionica o molecolare) di interesse. È una tecnica non distruttiva, perché non cerca di modificare la natura chimica dell'analita in questione.
Per eseguire questa analisi, almeno due elettrodi sono indispensabili: uno di riferimento e un altro indicatore o lavoro. Allo stesso modo, ci deve essere un voltmetro ad alta impedenza, con cui le tensioni vengono misurate senza consentire un flusso di elettroni apprezzabile tra i due elettrodi e le soluzioni che li circondano.
 Rappresentazione generale degli elementi necessari per un'analisi potenziometrica. Fonte: Gabriel Bolívar.
Rappresentazione generale degli elementi necessari per un'analisi potenziometrica. Fonte: Gabriel Bolívar. Sopra abbiamo una rappresentazione generale dell'assemblea per un'analisi potenziometrica. Nel compartimento in cui viene introdotto l'elettrodo indicatore è la specie la cui concentrazione vogliamo determinare; Mentre nell'elettrodo di riferimento abbiamo un'altra soluzione, in cui conosciamo le concentrazioni dei suoi componenti.
La lettura della tensione registrata è dovuta, in linea di principio, alla specie di interesse che si avvicina all'elettrodo indicatore. Con questa tensione calcoliamo la concentrazione di questa specie, ad esempio quella degli ioni Ca2+, Ag+, H+, N / a+, K+, Cl-, eccetera. La potenziometria ha usi, quindi, nella chimica clinica, ambientale, analitica e fisico.
[TOC]
Fondamenti
La tensione determinata nelle analisi potenziometriche è quella della cellula ecellula, che è la differenza tra le tensioni causate dai due elettrodi, l'indicatore e il riferimento. Gli elettrodi sono sensibili alle attività delle molecole o degli ioni che li circondano, essendo in grado di accettarli elettroni o al contrario.
I due compartimenti sono collegati, quindi l'elettrodo fluisce in cui si verifica la riduzione (catodo), all'elettrodo in cui si verifica l'ossidazione (anodo) (anodo).
Tuttavia, questo trasferimento di elettroni (o corrente) è quasi nullo, poiché altrimenti le reazioni redox si evolverebbero per modificare completamente le concentrazioni e le identità delle specie coinvolte.
Può servirti: bromuro di idrogeno (HBR)Invece, il voltmetro consente a malapena il passaggio degli elettroni, in modo che vi sia una lettura di tensione stabile e che la cella possa raggiungere l'equilibrio termodinamico.
Si dice quindi che la potenziometria sia una tecnica non distruttiva, perché pochi ioni o molecole si trasformano nel processo di misurazione, che è anche reversibile.
Equazioni principali
Potenziale cellulare
Il potenziale della cellula è correlato alle attività o alle concentrazioni delle specie di interesse attraverso l'equazione di Nernst:
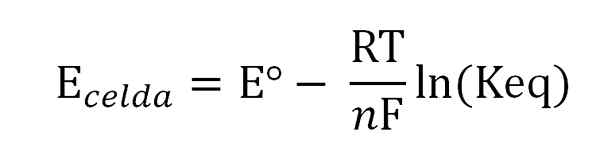 Equazione di Nernst. Fonte: Gabriel Bolívar.
Equazione di Nernst. Fonte: Gabriel Bolívar. Dove eº è il potenziale della stessa cella in condizioni standard, f La costante di Faraday, N Il numero di elettroni trasferiti, r la costante del gas e Keq la costante di bilanciamento della reazione globale. I calcoli vengono effettuati cancellando Keq dalla lettura di Ecellula, e calcolare la concentrazione desiderata della tua espressione di equilibrio.
Tuttavia, è conveniente calcolare le concentrazioni per un percorso più semplice. Per convenzione, il potenziale della cellula è anche dato dalla seguente equazione:
Ecellula = Egriglia- Ebue
Dove egriglia È il potenziale per la semi -media di riduzione, in cui si trova l'elettrodo indicatore; mentre ebue È il potenziale per l'ossidazione semi -media, in cui abbiamo l'elettrodo di riferimento. Pertanto, l'equazione può essere riscritta come:
Ecellula = Eindicatore - Eriferimento + EJ
Essere eJ uguale al potenziale causato dalle articolazioni del ponte articolare. In pratica, eJ Non può essere determinato, ma assicurarsi che il suo valore sia il più minimo possibile utilizzando soluzioni molto diluite o garantire che le composizioni in entrambi i compartimenti siano simili.
Potenziale dell'analita
Dall'equazione precedente possiamo calcolare eindicatore, che è il potenziale che ci interessa davvero. Con quel valore, applichiamo di nuovo l'equazione di Nernst:
Può servirti: acetonitrile (C2H3N)Eindicatore = Eº - (RT/NF) LN (rosso/ox)
La rete è la forma ridotta dell'analita o delle specie di interesse e il bue è la sua forma ossidata. Supponendo che l'analita sia i cationi Zn2+ Su un elettrodo di zinco metallico, avremmo:
Eindicatore = EºZn2+/Zn - (RT/NF) LN (1/AZn2+)
Dove AZn2+ È l'attività di cation zn2+, che con aggiustamenti sperimentali è abbastanza vicino alla sua concentrazione, [Zn2+". Da questa equazione la concentrazione di Zn viene cancellata2+, che come si può vedere, influisce direttamente sul valore di Eindicatore.
La forma ridotta di zinco, Zn, presenta un'attività uguale a 1. Pertanto, l'equazione generale per i cationi arrugginiti di un metallo che funge da elettrodo sarà uguale a:
Eindicatore = EºMn+/m - (RT/NF) LN (1/AM+N)
Ma questo vale solo nel caso degli elettrodi delle prime specie.
Elettrodi
Gli elettrodi, oltre al voltmetro, sono gli elementi più importanti di qualsiasi analisi potenziometrica. Alcuni di loro saranno menzionati di seguito.
Prima specie
I primi elettrodi di specie sono metalli che si ossidano per causare cationi, conducendo elettroni al voltmetro. Alcuni di questi sono i seguenti: AG, Zn, Cu, Hg, SN, TL, CD e BI.
Non tutti i metalli fungono da elettrodi di prima classe, perché non dovrebbero presentare irregolarità o superfici cristalline coperte da strati di ossido che causano tensioni instabili.
Seconda specie
Gli elettrodi di seconda specie, d'altra parte, sono anche metallici, ma contengono anche un sale sulla loro superficie, la cui solubilità dipende dalle reazioni redox che si svolgono. Ad esempio, gli elettrodi AG-AGCL e HG-HG2Cl2 (Calomel), sono elettrodi di seconda specie.
Ioni selettivi
Gli elettrodi a ioni selettivi, noti anche come membrane, sono quelli che sono sensibili a uno specifico ione o molecola, che si intrufola attraverso una membrana progettata solo per lui da passare e non le altre specie in soluzione.
Può servirti: reagente limitante ed eccessivoL'esempio preferito di questo tipo di elettrodo è quello del vetro, costruito per determinare la concentrazione di ioni H3O+ o h+, E quindi fungere da pehometro.
Applicazioni di potenziometria
Chimica ambientale
La potenziometria è stata utilizzata in chimica ambientale nella determinazione degli ioni CN-, F- e non3-, così come l'ammoniaca nelle correnti d'acqua.
Chimica clinica
Gli elettrodi selettivi sono molto utili quando il supporto di misurazione è complesso. Pertanto, gli altri ioni o molecole interferiranno con le letture.
Questa caratteristica è particolarmente benefica nelle determinazioni potenziometriche eseguite all'interno delle stesse cellule, in cui vengono iniettati i microelettrodi per determinare le concentrazioni di K K+, N / a+, Cl-, AC2+ o h+.
Gradi potenziometrici
Supponiamo che nel mezzo in cui abbiamo l'elettrodo indicatore viene aggiunto un titolo che reagi con l'analita e, quindi, modifica la sua concentrazione. Quindi si verificheranno cambiamenti nella Ecellula, che corrisponderà allo stesso modo al cambiamento di pH in una titolazione della base acida.
Quindi, graficamente ecellula vs. VTitulante, Possiamo determinare il punto di svolta o l'equivalenza, e con ciò sapremo la concentrazione dell'analita.
I gradi potenziometrici sono ampiamente utilizzati nei laboratori di chimica analitica e fisico. Alcuni degli analiti che possono essere determinati con questa tecnica sono i seguenti: Faith2+, HCO3-, AC2+, Mg2+, Cu2+, Acido ascorbico, Haluros, tra gli altri.
Tutti i gradi, in una certa misura, possono essere seguiti tramite potenziometrica invece di ricorrere agli indicatori e ai loro punti finali.
Riferimenti
- Giorno, r., & Underwood, a. (1986). Chimica analitica quantitativa (Quinto ed.). Pearson Prentice Hall.
- Skoog d.A., Ovest d.M. (1986). Analisi strumentale. (Secondo ed.). Inter -American., Messico.
- Dottore. Doug Stewart. (2020). Definizione di potenziometria. Recuperato da: Chemicool.com
- Harvey David. (5 giugno 2019). Metodi potntiometrici. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- Britannica Enciclopedia. (2020). Elettrogravimetria. Recuperato da: Britannica.com
- Wikipedia. (2020). Metodi elettroanalitici. Recuperato da: in.Wikipedia.org
- « Funzionamento dell'elettrodo di calomel, caratteristiche, usi
- Stimolando i tipi di farmaci e le loro caratteristiche »

