Funzionamento dell'elettrodo di calomel, caratteristiche, usi

- 1645
- 188
- Rosolino Santoro
Lui Elettrodo Calomel o Calomelanes è un elettrodo secondario che consente di determinare i potenziali semi -vita, grazie alla reazione che si verifica tra mercurio e cloruro di mercurio (I), HG2Cl2, Precedentemente noto come Calomel. Entrambi i reagenti, Hg e Hg2Cl2, Vincono o perdono elettroni a seconda del mezzo in cui l'elettrodo è immerso.
Normalmente abbreviato come EC, questo elettrodo sostituisce in molte misurazioni all'elettrodo di idrogeno standard (SHE), poiché è più facile da costruire e meno rischioso da manipolare (nonostante abbia mercurio). All'interno contiene una soluzione KCL come mezzo elettrolitico per il flusso di elettroni.
 Elettrodo Calomel in misura completa. Fonte: Chandrajit Karmakar, CC BY-SA 4.0, via Wikimedia Commons
Elettrodo Calomel in misura completa. Fonte: Chandrajit Karmakar, CC BY-SA 4.0, via Wikimedia Commons L'elettrodo di Calomel può avere varianti diverse a seconda delle sue dimensioni, o più importanti, di concentrazione di KCL. Quando la soluzione KCL è satura, parliamo di un elettro di Saturado Calomel (ESC). L'ESC è più facile da preparare rispetto alla CE, ma più sensibile alle variazioni di temperatura.
L'uso di questo elettrodo ha permesso di determinare i potenziali semi -vita per innumerevoli reazioni redox. È anche un dispositivo ricorrente in determinazioni potenziometriche, che cercano di conoscere la quantità di analita a seconda della cellula e del potenziale misurato.
[TOC]
Funzionamento
Quindi quell'elettrodo di Calomel funziona, la coppia HG-HG2Cl2 Devi reagire, sia vincere o perdere elettroni.
Catodico
Quando la riduzione o il guadagno degli elettroni si verifica all'interno dell'elettrodo di calomel, abbiamo le seguenti reazioni:
Hg2Cl2 → Hg22+ + 2cl- (Ionizzazione)
Hg22+ + 2e- → 2hg (riduzione)
Hg2Cl2 + 2e- → 2hg +2cl- (Reazione netta)
Può servirti: reazione esotermicaPertanto, l'HG2Cl2 Vinci elettroni che si riducono al mercurio metallico.
Il potenziale e dell'elettrodo quando si verifica la riduzione è dato dall'equazione:
E = Eº - 0.0591 registro [CL-"
Dove si osserva che dipende esclusivamente dalla concentrazione degli ioni cl-, Essere il potenziale di riduzione standard per questo elettrodo misurato davanti all'elettrodo di idrogeno standard.
Anodico
All'interno dell'elettrodo può anche verificarsi un processo di ossidazione:
2Hg → Hg22+ + 2e- (Ossidazione)
Hg22+ + 2cl- → Hg2Cl2 (Precipitazione)
2Hg +2cl- → Hg2Cl2 + 2e- (Reazione netta)
Cioè, che il mercurio si ossida per generare più HG2Cl2.
Il potenziale E in questo caso è dato da:
E = Eº + 0.0591 registro [CL-"
E ancora, e dipende da [CL-".
Reazione generale
La reazione generale per l'elettrodo di Calomel è:
Hg2Cl2(s) + 2e- ⇌ 2Hg (L) + 2Cl-
Il senso di equilibrio dipenderà dal mezzo in cui l'elettrodo è in contatto. Il cl- Determina la solubilità di Hg2Cl2, che a sua volta ha un impatto sulla formazione o sull'ossidazione dell'HG.
E il potenziale determinato per una specifica concentrazione di ioni Cl- Sarà uguale a:
Ecalomelano = Egriglia - Ebue
Essere ecalomelano Il potenziale che viene riportato come riferimento in alcune potenziali tabelle.
Caratteristiche dell'elettrodo Calomel
Rappresentazione del semi
Calomel Elettrode Semi -Edge può essere rappresentato come segue:
Pt | Hg | Hg2Cl2| Cl- (XM)
Dove è importante solo la concentrazione di ioni cl-, espresso in molarità o normalità. Il potenziale E dell'elettrodo varierà se è riempito con soluzioni di diverse concentrazioni di KCL.
Ad esempio, una EC con KCL 0.1 m ha un e pari a 0.3356 V a 25 ° C; Mentre l'ESC, con KCL saturo, ne ha uno e pari a 0.2444 V alla stessa temperatura.
Può servirti: isopentano: struttura, proprietà, usi, ottenimentoPertanto, la concentrazione di KCl è la caratteristica più importante degli elettrodi di calomel, in quanto indicherà cosa usare quando vengono eseguiti i calcoli delle misurazioni potenziometriche.
Commercialmente, si ottengono tre tipi di elettrodi di calomel: saturi (ESC), il diciannovesimo (0.1 n o 0.1 m kcl) e il normale (1 n o 1 m kcl). Un elettrodo di Calomel 1 M KCl sarebbe rappresentato come:
Pt | Hg | Hg2Cl2| Cl- (1 m)
Feste
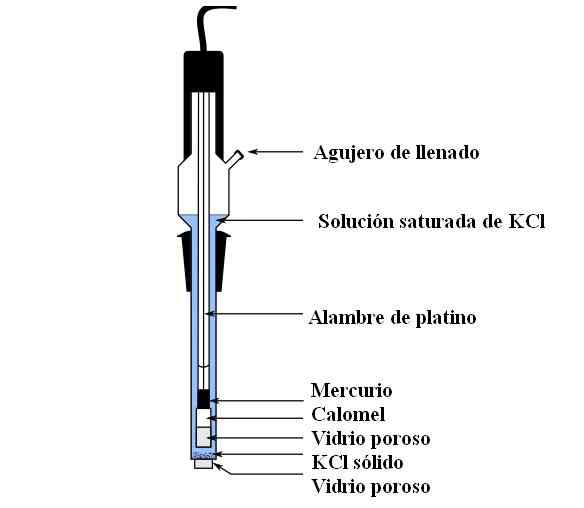 Parti di elettrodi Calomel. Fonte: Bachi-Bouzou, CC0, via Wikimedia Commons
Parti di elettrodi Calomel. Fonte: Bachi-Bouzou, CC0, via Wikimedia Commons Nell'immagine superiore mostriamo le parti principali di un normale elettrodo di calomel. È realizzato in vetro ed è composto da due contenitori: uno esterno, che viene messo in contatto elettrochimico con il mezzo delle misurazioni e contiene la soluzione KCL; E uno interno, dove poggia la miscela HG-HG2Cl2.
Internamente, l'elettrodo di Calomel contiene mercurio liquido, su cui viene rispettata una pasta Hg2Cl2 inumidito con mercurio. Questa è la fase più attiva dell'elettrodo. Il vetro poroso viene utilizzato per consentire solo l'ingresso o l'uscita degli ioni cl-, Ma non i cristalli di HG2Cl2 o il mercurio cade.
Un cavo in platino, in cui fluiscono gli elettroni, viene immerso nel mercurio ed è responsabile del collegamento dell'elettrodo con il voltmetro e il circuito esterno in questione.
Attraverso il foro di riempimento, viene versata la soluzione KCL, che contiene distolti di sale sciolti. Nel frattempo, nella parte inferiore dell'elettrodo abbiamo un'apertura molto piccola in un vetro poroso, che entra a contatto diretto con il mezzo di misurazione. Lo scopo del vetro poroso è consentire il contatto senza scambi indesiderati di sostanze che contaminano l'elettrodo o il campione.
Può servirti: cicloesco: struttura, proprietà, sintesi e usiVantaggi
L'elettrodo Calomel presenta i seguenti vantaggi rispetto all'elettrodo di idrogeno standard:
-Facile da costruire e manipolare
-Il suo potenziale cellulare rimane costante anche se l'acqua evapora
-Non hai bisogno di un ponte salino
L'ESC è il più semplice da costruire dagli elettrodi di Calomel, poiché KCl è sufficiente per dissolversi fino a formare i loro cristalli. Quindi la soluzione sarà satura e pronta a perdere l'elettrodo.
Svantaggi
L'elettrodo di Calomel, tuttavia, presenta i seguenti svantaggi:
-Contenendo mercurio liquido, può esercitare un impatto negativo sull'ambiente
-Non può essere utilizzato per analisi quantitative in campioni con una temperatura superiore a 60 ºC, poiché l'HG2Cl2 inizia a rompersi, causando il fallimento delle letture degli elettrodi
L'ESC ha anche lo svantaggio che è molto sensibile alle variazioni di temperatura.
L'elettrodo d'argento argento ha sostituito il calomel in molte determinazioni potenziometriche.
Applicazioni
L'elettrodo di Calomel è uno dei tanti elettrodi che vengono utilizzati quotidianamente nelle determinazioni potenziometriche, consentendo di ottenere i potenziali semi -vita degli analiti o delle specie di interesse.
Inoltre, l'elettrodo di Calomel viene utilizzato nelle misurazioni del pH e nella voltmetria ciclica.
Riferimenti
- Giorno, r., & Underwood, a. (1986). Chimica analitica quantitativa (Quinto ed.). Pearson Prentice Hall.
- Wikipedia. (2020). Elettrodo di calomel saturo. Recuperato da: in.Wikipedia.org
- Generatico, Eni. (20 ottobre 2018). Elettrodo calomel. Dizionario e glossario croato-inglese. KTF-SPLIT. 30 ottobre. 2020. Recuperato da: glossario.Periodni.com
- Skoog d.A., Ovest d.M. (1986). Analisi strumentale. (Secondo ed.). Inter -American., Messico.
- Colline, g., Ives, d. T. (1950). L'elettrodo Calomel. Natura 165, 530 doi.org/10.1038/165530A0
- Jmgav. (9 dicembre 2012). Potenziometria (ii): elettrodi. Estratto da: Triplenlace.com
- « Caratteristiche del paradigma socio -critico, metodi, rappresentanti
- Fondamenti di potenziometria, equazioni, elettrodi »

