Struttura della piridina, proprietà, usi, tossicità, sintesi
- 4622
- 1142
- Rosolino Santoro
IL Piridina È un'ammina aromatica la cui formula chimica è C5H5N. È la versione azotata del benzene, come gruppo -CH = è stata sostituita da un atomo di azoto (N). Insieme al pirolo, la piridina forma il gruppo di ammine aromatiche più semplici di tutte.
Inizialmente la piridina si è verificata dal catrame di Hulla, ma era un piccolo metodo di prestazione. Ciò ha portato alla creazione di diversi metodi per la sua sintesi chimica, prevalendo quella in cui viene utilizzata la reazione della formaldeide, dell'acetaldeide e dell'ammoniaca.
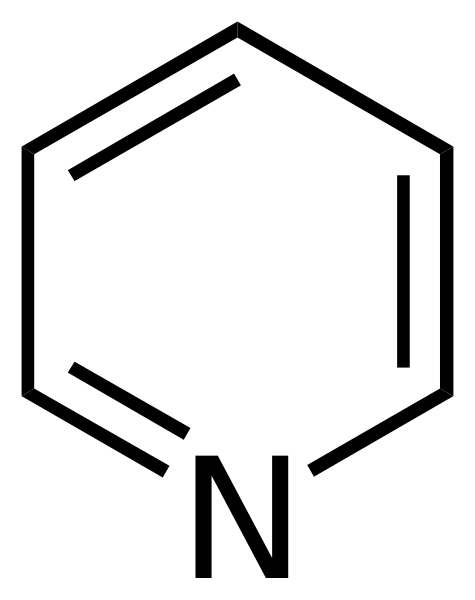 Formula strutturale di piridina. Fonte: CalVo. / Dominio pubblico
Formula strutturale di piridina. Fonte: CalVo. / Dominio pubblico La piridina fu ottenuta per la prima volta da Thomas Anderson (1843), un chimico esposte, che attraverso il riscaldamento di carni e ossa di animali produceva un olio da cui la piridina veniva purificata.
 Thomas Anderson (luglio 1819)
Thomas Anderson (luglio 1819) La piridina viene utilizzata come materia prima per la sintesi di composti che eliminano e controllano la proliferazione di insetti, funghi, erbe, ecc. Viene anche usato nell'elaborazione di numerosi farmaci e vitamine, oltre ad essere usato come solvente.
La piridina è un composto tossico che può in modo cronico danni al fegato, ai reni e al funzionamento del sistema nervoso centrale. La piridina può entrare nel corpo a causa di ingestione, inalazione e diffusione attraverso la pelle. È noto nella sostanza chimica perché è una sostanza in grado di causare impotenza negli uomini.
[TOC]
Struttura della piridina
Molecolare
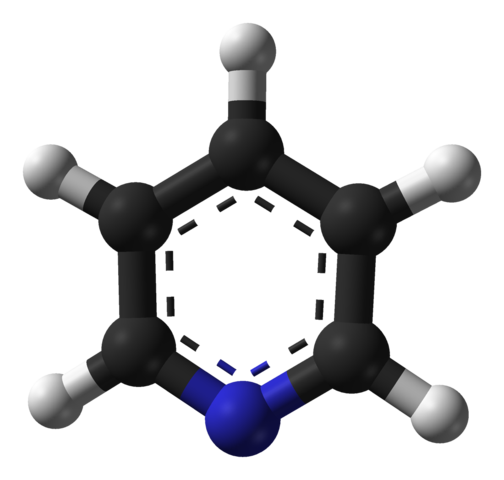 Struttura molecolare della piridina. Fonte: Benjah-BMM27 / Dominio pubblico
Struttura molecolare della piridina. Fonte: Benjah-BMM27 / Dominio pubblico L'immagine superiore mostra la struttura molecolare della piridina rappresentata da un modello di sfere e barre. Come si può vedere, la sua molecola è molto simile a quella del benzene, con l'unica differenza che ha uno dei suoi carboni (sfere nere) sostituita da azoto (sfera blu).
L'azoto, poiché è più elettronegativo, attira la densità elettronica verso se stessa, il che crea un momento di dipolo permanente nella piridina. Pertanto, le molecole di piridina interagiscono attraverso le forze dipolo-dipolo.
Gli atomi di idrogeno sono le regioni più povere degli elettroni, quindi saranno orientati nella direzione dell'atomo di azoto di una molecola vicina.
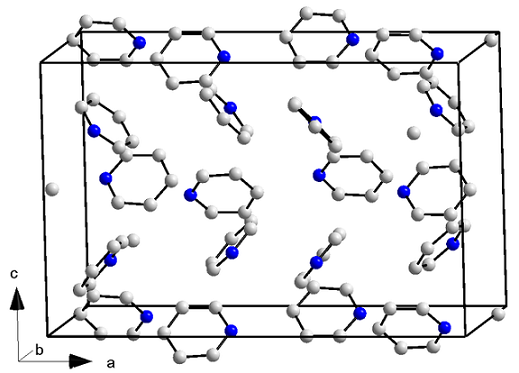
Cristallino
 Struttura cristallina di piridina. Fonte: ORCI/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0)
Struttura cristallina di piridina. Fonte: ORCI/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0) Le molecole di piridina non hanno solo forze dipolo-dipolo, ma anche con interazioni di anelli aromatici. Pertanto, queste molecole riescono a posizionarsi per causare un cristallo di struttura ortorrombica (immagine superiore) a una temperatura di -41,6 ° C.
Proprietà della piridina
 Campione di piridina. LHCHEM/CC BY-SA (https: // CreativeCommons.Org/licenze/by-sa/3.0)
Campione di piridina. LHCHEM/CC BY-SA (https: // CreativeCommons.Org/licenze/by-sa/3.0) Aspetto fisico
Liquido incolore, con un odore penetrante, simile a quello del pesce.
Può servirti: metodo di bilanciamento redox: passaggi, esempi, eserciziMassa molare
79,1 g/mol
Densità
0.9819 g/ml
Punto di fusione
-41,6 ºC
Punto di ebollizione
115,2 ºC
Solubilità
È miscibile con acqua e anche con alcol, etere, etere di petrolio, oli e molti liquidi organici in generale.
Pressione del vapore
16 mmHg a 20 ºC.
Densità del vapore
2,72 in relazione all'acqua = 1
Indice di rifrazione (nD)
1.5093
Sostanza vischiosa
0,88 cp
Momento dipolare
2,2 d
punto di accensione
21 ºC
Temperatura di auto-direzione
482 ºC
Decomposizione
Se riscaldato alla decomposizione emette un fumo di cianuro.
Corrosione
La piridina in forma liquida attacca alcune forme di plastica, gomme e rivestimenti.
ph
8,5 (soluzione 0,2 m in acqua)
Basicità e reattività
La piridina è una base debole. È un'ammina terziaria la cui soluzione di 0,2 m in acqua produce un pH di 8,5. Ha poca affinità per gli elettroni a causa dell'elettronegatività dell'azoto, quindi i loro carboni di solito non subiscono una sostituzione elettrofila.
La piridina sperimenta una sostituzione nucleofila, preferibilmente nelle posizioni c4 e C2 Dal ring. A causa della sua capacità di donare elettroni, la piridina è più ossidazione più del benzene e reagisce violentemente con acido solforico, acido nitrico e anidride maleico.
Usi della piridina
Pesticidi
La piridina è un precursore di erbicidi anteriori e diquat. Allo stesso modo, serve per la sintesi dell'insetticida clorpifos, il cui passo iniziale è la clorazione della piridina. È anche la materia prima iniziale per ottenere il fungicida in base alla pirizione.
Solvente
La piridina è un solvente polare, utilizzato per le reazioni del rivenditore ed estrazione antibiotica. La piridina viene utilizzata come solvente nelle industrie di vernice e gomma e anche nei laboratori di ricerca come solvente nell'estrazione di ormoni vegetali.
Medicinale
La piridina funge da punto iniziale nella sintesi di cetilpiridinio e laurilpiridinio, composti che sono usati come antisettici nei prodotti per la cura orale e dentale. La molecola di piridina fa parte della struttura chimica di numerosi farmaci.
Ad esempio, l'esmeprazolo, usato nel trattamento del reflusso gastroesofageo. La loratidina è un altro farmaco preparato basato sulla piridina, noto come chiaritina, che viene utilizzato come trattamento dei processi allergici.
Le compresse di piridina (fenazopiridina) sono usate nel trattamento sintomatico di un'irritazione del tratto urinario, che è accompagnato, in alcuni casi, dolore, bruciore e urgenza di urinare. La fenazopiridina è un colorante che svolge una funzione analgesica nel tratto urinario.
Di-Acilhidrazina è un derivato della piridina che ha un'attività antibatterica che esercita su batteri gram negativi, come E. coli, e batteri gram positivi, come S. Albus.
La piridina funge da base per la piridina tiazolo [5,4-6], composta da attività antivirale, in particolare contro il virus dell'influenza di massa β. La 2-acetilpiridina, un derivato della piridina, ha una grande attività antitumorale ed è un inibitore della leucemia.
Può servirti: ossido di mercurio (HG2O)Altri
La piridina viene utilizzata nella produzione di vitamine, prodotti in gomma, adesivi, dipinti e insetticidi. Viene anche usato nella denaturazione dell'alcool e nella colorazione di alcuni tessuti.
Il 20 % della piridina viene utilizzato nella preparazione della piperidina. La piperidina interviene in vulcanizzazione e agricoltura.
La piridina viene anche utilizzata nella sintesi di resine policarbonate, come sapore alimentare e come reagente per il rilevamento del cianuro.
Tossicità
- La piridina entra nell'organismo principalmente a causa dell'inalazione e della diffusione attraverso la pelle. L'esposizione acuta alla piridina può produrre irritazioni e ustioni negli occhi e nella pelle.
- La piridina può avere origine dermatite e allergia nella pelle. Lo sviluppo dell'allergia può essere accompagnato oltre al prurito ed eruzione.
- L'inalazione di piridina può causare irritazione al naso e alla gola, accompagnata dalla tosse e da un respiro di respirazione asmatica.
- Per ingestione, la piridina può causare nausea, vomito, diarrea e dolore addominale. Allo stesso modo, l'incorporazione di un'alta dose di piridina nell'organismo può causare: mal di testa, affaticamento, sbiadimento, sbalorditivo, vertigini, confusione e infine mangiare e morte.
- Gli organi più colpiti dall'azione della piridina sono il fegato, i reni, i genitali maschili e il sistema nervoso centrale. Può anche agire sul midollo osseo, inducendo la produzione di piastrine del sangue. Un'azione cancerogena di piridina non è stata evidenziata negli animali.
L'OSHA ha stabilito un'esposizione nell'aria di 5 ppm per 8 ore di lavoro lavorativo.
Sintesi
I primi metodi per ottenere piridina erano basati sulla sua estrazione di materiali organici. Thomas Anderson (1843) ottenuto per la prima volta la piridina riscaldando carni e ossa di animali. In una prima fase, Anderson ha prodotto un olio da cui è riuscito a distillare la piridina.
Tradizionalmente, la piridina è stata ottenuta dal catrame di Hulla o dalla gassificazione del carbone. Queste procedure erano ingombranti e di scarse prestazioni, poiché la concentrazione di piridina in queste materie prime era molto bassa. Era necessario un metodo di sintesi.
Metodo Chichibabin
Sebbene ci siano molti metodi per la sintesi della piridina, la procedura Chichibabin introdotta nel 1923 è ancora utilizzata principalmente. In questo metodo la piridina viene sintetizzata dalla reazione di formaldeide, acetaldeide e ammoniaca, che sono reagenti economici.
Può servirti: tipo di collegamento di 02Nel primo stadio, la formaldeide e l'acetaldeide reagiscono per formare il composto di acroleina, in una reazione di condensa di Knoevegel, formando anche acqua.
 Condensa di piridina da Acroleína e Acetaldeide
Condensa di piridina da Acroleína e Acetaldeide Infine, in un secondo stadio, Acroleína reagisce con la formaldeide e l'ammoniaca per formare diidropiridina. Successivamente, la diidropiridina viene ossidata in piridina in una reazione a 350-550 ° C in presenza di un catalizzatore solido, ad esempio silice -alumina.
Reazioni
Sostituzioni elettrofiliche
Queste sostituzioni di solito non si verificano a causa della bassa densità di piridina elettronica.
La solfanazione presenta maggiori difficoltà della nitrazione. Ma i bromini e la clorazione si verificano più facilmente.
Piridina-N-ossido
Il sito di ossidazione nella piridina è l'atomo di azoto, essendo l'ossidazione prodotta dalle pesche (acidi che hanno un gruppo OOH). L'ossidazione dell'azoto promuove la sostituzione elettrofila nei carboni 2 e 4 di piridina.
Sostituzioni nucleofili
La piridina può sperimentare diverse sostituzioni nucleofile a causa della bassa densità elettronica dei carboni dell'anello di piridina. Queste sostituzioni si verificano più facilmente nella molecola di piridina modificata da bromo, cloro, fluoro o acido solfonico.
I composti effettuati da attacchi nucleofili alla piridina sono di solito: alcossidi, tyolati, ammine e ammoniaca.
Reazioni radicali
La piridina può essere dimerizzata da reazioni radicali. La dimerizzazione della piridina radicale viene eseguita con sodio elementare o nichel Raney, essendo in grado di produrre 4,4'-bipperidina o 2,2'-bipperidina.
Reazione sull'atomo di azoto
Gli acidi, secondo Lewis, vengono facilmente aggiunti all'atomo di azoto della piridina, formando sali di piridina. La piridina è una base di Lewis che dona un paio di elettroni.
Reazione di idrogenazione e riduzione
La piperidina è prodotta dall'idrogenazione della piridina con nichel, cobalto o rutenio. Questa reazione è fatta ad alte temperature accompagnate dall'uso di un catalizzatore.
Riferimenti
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. (10th Edizione.). Wiley Plus.
- Carey f. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Morrison e Boyd. (1987). Chimica organica. (Quinta edizione). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Piridina. Recuperato da: in.Wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2020). Piridina. Database PubChem., CID = 1049. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Laura Foist. (2020). Piridina: struttura, formula e proprietà fisiche. Studio. Recuperato da: studio.com
- Atof Ali Altaf, Adnan Shahzad, Zarif Gul, Nasir Rasool, Amin Badshah, Bhajan Lal, Ezzat Khan. (2015). Una revisione sull'importanza medicinale dei derivati della piridina. Journal of Drug Design e Medicinal Chemistry. Vol. 1, no. 1, pp. 1-11. Doi: 10.11648/j.JDDMC.20150101.undici
- Webmd. (2020). Compressa di piridina. Estratto da: WebMD.com
- Dipartimento della salute e senior del New Jersey. (2002). Piridina. [PDF]. Recuperato da: NJ.Gov
- « Cronologia C ++, caratteristiche, tipi di dati, esempi
- Funzioni di acidi grassi essenziali, importanza, nomenclatura, esempi »

