Attacco nucleofilo nucleofilo, tipi, esempi, nucleofilia
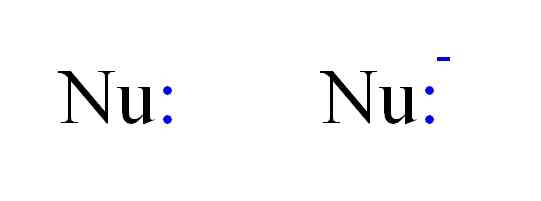
- 1045
- 73
- Benedetta Rinaldi
UN nucleofilo È tutto atomo, ione o molecola che cerca di donare coppie di elettroni a sostanze con carichi o regioni positive. La parola significa "amore per i nuclei". Quando un atomo o una regione molecolare è scarso negli elettroni, sperimenta una forza di maggiore attrazione da parte dei nuclei atomici; E precisamente, questa attrazione attira i nucleofili.
Pertanto, quando sono attratti i segni opposti, i nucleofili devono essere specie negative; o almeno, possedere regioni altamente negative a causa di una concentrazione di elettroni locale o sparsa.
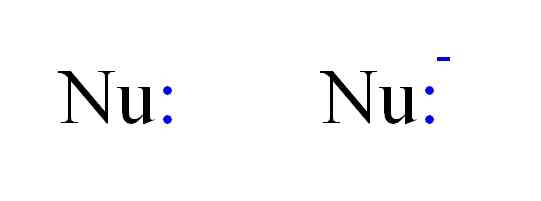 I due tipi più frequenti di nucleofili in chimica. Fonte: Gabriel Bolívar.
I due tipi più frequenti di nucleofili in chimica. Fonte: Gabriel Bolívar. Pertanto, un nucleofilo può essere rappresentato dalle lettere NU, come nell'immagine sopra. I doppi punti in blu corrispondono a un paio di elettroni, che donano all'elettrofilo; Questo è, l'atomo o la povera molecola di elettroni. Si noti che il nucleofilo può essere neutro o anionico, tuttavia entrambi donavano coppie di elettroni.
L'attacco dei nucleofili agli elettrofili è la pietra angolare di innumerevoli reazioni e meccanismi organici. Un esempio di nucleofilo è l'anione idrossilico, OH-, Questo si comporta anche come una base. Tuttavia, la nucleofilia non dovrebbe mai essere confusa con la basicità di una sostanza.
[TOC]
Attacco nucleofilo
I nucleofili sembrano. La seguente equazione chimica rappresenta l'attacco nucleofilo:
Gnu: + R-LG → R-NU + LG:
Il nucleofilo NU: dona la sua coppia di elettroni A R, collegata a un gruppo LG elettronegativo. In tal modo, il collegamento R-LG è rotto, è formato Emigra di LG e il nuovo collegamento R-NU. Questa è la base per molte reazioni organiche.
Si vedrà nella prossima sezione che un nucleofilo può persino essere un anello aromatico, la cui densità elettronica è dispersa al suo centro. Allo stesso modo, un nucleofilo può diventare un legame Sigma, il che significa che gli elettroni dello stesso emigrano o saltano nei nuclei vicini.
Può servirti: cromato di potassio (K2CRO4)Tipi di nucleofili
Esistono diversi tipi di nucleofili, ma il vasto maggiore.
Specie con coppie di elettroni liberi
Quando parliamo di specie con coppie di elettroni liberi, ci riferiamo ad anioni o molecole con atomi elettronegativi, come ossigeno, azoto e zolfo. Nella sezione esempi saranno visti molti nucleofili di questo tipo, a parte l'anione oh- Già menzionato.
Doppi collegamenti
Un nucleofilo può avere doppi legami, che sono responsabili dell'attacco nucleofilo. Tuttavia, devono essere doppi legami con una densità elettronica apprezzabile, quindi nessuna molecola che li possieda sarà considerata un forte nucleofilo; Cioè, non avrà un'alta nucleofilia.
Ad esempio, considera l'anello di benzene nella seguente reazione dell'alchilazione (reazione di Friedel-Crafts):
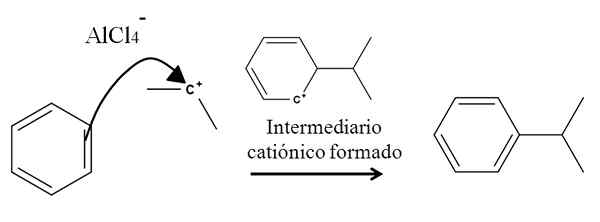 Alchilazione benzene nella sostituzione elettrofila aromatica. Fonte: Gabriel Bolívar.
Alchilazione benzene nella sostituzione elettrofila aromatica. Fonte: Gabriel Bolívar. La presenza di una miscela ALCL3-(Ch3)2CHCL ha origine Carbocalizzazione isopropilica. Il suo carico e instabilità positivi attirano fortemente gli elettroni di uno dei doppi legami del benzene, che attacca il carbocalizzazione, come rappresentato dalla freccia.
Nel processo, si forma una breve intermadria cationica e aromatica, che si trasforma finalmente nel prodotto giusto.
Oltre al benzene, altre sostanze con doppie legami possono agire come nucleofili, a condizione che le condizioni di reazione siano le più appropriate. Allo stesso modo, ci devono essere atomi situati vicino al doppio legame che donano la densità elettronica, in modo che si "ricaricano" di elettroni.
Collegamenti SIGMAS
I legami Sigma in quanto tali non sono nucleofili; Ma può comportarsi come tale una volta che inizia una reazione e inizia il meccanismo. Considera il seguente esempio:
Può servirti: sali di linding: cosa sono, nomenclatura, proprietà, esempi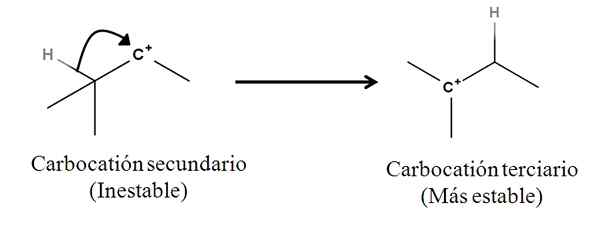 Conversione di un carbocalizzazione secondario in terziario mediante migrazione da un anione idruro. Fonte: Gabriel Bolívar.
Conversione di un carbocalizzazione secondario in terziario mediante migrazione da un anione idruro. Fonte: Gabriel Bolívar. Il legame Sigma C-H adiacente al carbocalizzazione si muove verso di lui che si comporta come un nucleofilo (vedi movimento della freccia curva). In questo senso, il risultato è che l'anione H si muove- al carbonio vicino, ma così rapidamente che il legame Sigma e la sua coppia di elettroni come agente nucleofilo di questo meccanismo sono considerati.
Esempi nucleofili
Questa sezione menzionerà diversi esempi del primo tipo di nucleofili, che sono molto abbondanti e importanti nella chimica organica e inorganica.
Alogenuro
Halogenuros (f-, Cl-, Br- e io-) Sono nucleofili. Devo donare una delle loro quattro coppie di elettroni di valenza. A seconda della velocità con cui uno di questi halogenuros attacca l'elettrofia, avrà una nucleofilicità maggiore o minore.
In generale, l'I- È un nucleofilo migliore di f- e gli altri alogenuri, poiché è più facile formare un collegamento covalente perché è più polarizzabile; Cioè, più ingombrante e con meno tenacia per rinunciare alla sua coppia di elettroni.
Molecole di atomi elettronegativi
 Molecole d'acqua
Molecole d'acqua L'acqua, hah, è un nucleofilo, perché l'atomo di ossigeno ha un'alta densità negativa e coppie di elettroni liberi per donare e formare un legame covalente. Inoltre, gli alcoli, ROH, sono nucleofili, per le stesse ragioni di quelle dell'acqua.
Piccole molecole di azoto come l'ammoniaca, NH3, Tendono anche ad essere nucleofili. Questo perché l'azoto può donare la sua coppia solitaria di elettroni. Allo stesso modo, ammine, RNH2, Sono anche nucleofili.
E oltre alle piccole molecole con ossigeno o azoto, anche i solfuri contano come nucleofili. Questo è il caso dell'idrogeno solforato, h2S e i tiolle, rsh.
Lo zolfo è un nucleofilo migliore dell'ossigeno e dell'azoto perché è meno "aggrapparsi" alla sua coppia di elettroni, quindi è più facile donarlo. A questo fatto si deve anche aggiungere che il suo atomo è più voluminoso, cioè più polarizzabile e quindi in grado di formare legami covalenti con meno difficoltà.
Può servirti: metodo MOHR: fondamentali, reazioni, procedura, usiAnioni
Anioni ossigenati, azoto, solforzati e in generale molti di essi sono forti nucleofili. Questo perché ora hanno un carico negativo che intensifica ulteriormente la presenza della coppia di elettroni che donano.
Considera ad esempio i seguenti anioni posti in ordine decrescente di nucleofilia:
: Ch3- >: NH2- >: Oh- >: F-
Il carboanione ch3- È il nucleofilo più forte perché l'atomo di carbonio non stabilizza il carico negativo, i cui elettroni sono "disperati" dai nuclei vicini. Questo non accade con l'amiduro, NH2-, il cui atomo di azoto stabilizza meglio il carico negativo e produce la coppia di elettroni più facilmente rispetto all'OH- o f-.
Nucleofilia
La nucleofilia definisce quanto sia forte il carattere nucleofilo di una specie. Questo dipende da molti fattori, ma i più importanti sono l'impedimento sterico durante l'attacco nucleofilo e l'azione del solvente.
Più piccolo è il nucleofilo, più veloce ed efficace sarà il tuo attacco elettrofilo. Inoltre, quanto più basse le interazioni tra il solvente e il nucleofilo. Pertanto, secondo questo, l'I- ha una maggiore nucleofilia di F-.
Riferimenti
- Morrison, r. T. e Boyd, r, n. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Inter-American.
- Carey f. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. (10a edizione.). Wiley Plus.
- James Ashenhurst. (2020). Le tre classi di nucleofili. Recuperato da: MasterOrganicChemistry.com
- Professore Patricia Shaley. (2012). Nucleofili ed elettrofili. Università dell'Illinois. Recuperato da: butano.Chimica.Uiuc.Edu
- Wikipedia. (2020). Nucleofilo. Recuperato da: in.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (11 febbraio 2020). Definizione nucleofila in chimica. Recuperato da: Thoughtco.com
- Rachael Curtis. (5 giugno 2019). Nucleofilo. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- « Proprietà del sistema termodinamico, tipi, esempi
- Concetto, caratteristiche ed esempi di narratrici equist »

