Nessuna storia di metalli, proprietà, gruppi, usi

- 1783
- 455
- Lidia Valentini
IL Nessun metallo Sono un gruppo di elementi che si trovano sul lato destro della tavola periodica, ad eccezione dell'idrogeno che si trova nel gruppo 1 (AI), insieme a metalli alcalini. Se vuoi sapere cosa sono, devi guardare l'angolo in alto a destra del blocco P.
Gli atomi non metal sono relativamente piccoli e il loro strato elettronico esterno ha un numero elevato di elettroni. Tra gli elementi non metallici, i solidi, i liquidi e i gas sono disponibili; Sebbene siano principalmente in uno stato gassoso, molti di loro arricchiscono l'atmosfera.
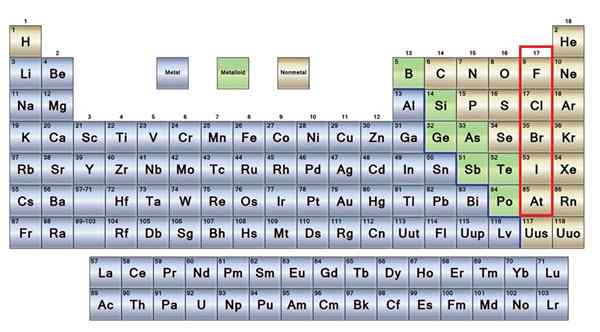 Elementi non metallici in marrone
Elementi non metallici in marrone Una buona parte dei non metalli è presente in tutti gli esseri viventi sotto forma di composti e macromolecole. Ad esempio: carbonio, ossigeno e idrogeno sono presenti in tutte le proteine, lipidi, carboidrati e acidi nucleici.
Il fosforo è presente in tutti gli acidi nucleici e in alcuni carboidrati e lipidi. Lo zolfo si trova in molte proteine. L'azoto fa parte di tutti gli acidi nucleici e le proteine.
D'altra parte, i gas sotterranei, il metano e i grezzi di petrolio sono quasi composti da elementi non metallici. In effetti, gli idrocarburi (carbonio e idrogeno) danno un'idea di quanto siano abbondanti i non metallici nonostante il loro numero inferiore di elementi nella tabella periodica.
[TOC]
Storia
Dall'antichità (3750 a.C.) Gli egiziani hanno usato il carbone per ridurre il rame presente nei loro minerali, come la Corvelita e la malachite.
Nel 1669, il marchio Hennin riuscì a isolare il fosforo delle urine raccolte. Henry Cavendish (1776) raggiunse l'identificazione dell'idrogeno, sebbene diversi ricercatori, tra cui Robert Boyle (1670), producevano idrogeno reagendo un forte acido con un metallo.
Carl Scheele ha prodotto ossigeno riscaldando l'ossido di mercurio con nitrati (1771). Curtois riuscì a isolare lo iodio, mentre cercava di preparare i saltatrici dalle alghe (1811). Balard e Gmelin isolarono l'orlo (1825).
Nel 1868, Janssen e Lockger indipendenti. Moissan riuscì a isolare il fluoruro (1886).
Nel 1894, Lord Rayleigh e Ramsey scoprirono Argon studiando le proprietà di azoto. Ramsay e Travers (1898) isolarono il Crypton, il neon e lo xeno dell'argon liquido, mediante distillazione criogenica dell'aria.
Proprietà fisiche e chimiche
 Lo zolfo è uno degli elementi non metallici più rappresentativi. Fonte: Ben Mills via Wikipedia.
Lo zolfo è uno degli elementi non metallici più rappresentativi. Fonte: Ben Mills via Wikipedia. Fisico
Alcune delle proprietà fisiche dei non metal sono:
-Hanno una bassa conduttanza elettrica, ad eccezione del carbonio sotto forma di grafite, che è un buon conduttore di elettricità.
Può servirti: heptano (c7h16): struttura, proprietà e usi-Possono verificarsi sotto l'aspetto fisico di solidi, liquidi o gas.
-Hanno una bassa conduttanza termica, ad eccezione del carbonio sotto forma di diamante che non si comporta come un isolatore termico.
-Hanno una piccola lucentezza, a differenza della luminosità del metallo in metallo.
-I solidi non metallici sono fragili, quindi non sono duttili o malleabili.
-Hanno punti bassi e bolliti.
-Possono presentare diverse strutture cristalline. Pertanto il fosforo, l'ossigeno e il fluoruro hanno una struttura cristallina cubica; Idrogeno, carbonio e azoto, esagonale; e zolfo, cloro, bromo e iodio, ortorrombico.
Chimica
I non metalli sono caratterizzati da un'energia di ionizzazione elevata e da un alto valore di elettronegatività. Il fluoro, ad esempio, ha la massima elettronegatività (3,98), essendo l'elemento più reattivo dei non metalli.
Ma sorprendentemente, l'elio dei gas nobili (5,5) e il neon (4.84) hanno la massima elettronegatività. Tuttavia, sono chimicamente inerti per avere strati elettronici esterni pieni.
Non metalli formano composti ionici con metalli e covalenti con non metalli.
Gli elementi non metallici stanno formando molecole diatomiche, collegate da legami covalenti. Nel frattempo, gli atomi di gas nobili sono sotto forma di unità atomiche.
Formano ossidi acidi che reagiscono con l'acqua originano gli acidi.
Gruppi non metal ed elementi

Gruppo 1
È costituito dall'idrogeno un gas incolore e igienico, dialetomico. Stato di ossidazione +1. Ha meno densità dell'aria. In stato solido presenta una struttura cristallina esagonale. L'idrogeno è un piccolo elemento reattivo.
Gruppo 14
Il carbonio è l'unico non metallico appartenente a questo gruppo. Il carbonio sotto forma di grafite è un solido lucido, con una struttura cristallina esagonale. Ha un'alta conducibilità elettrica. I suoi stati di ossidazione più comuni sono +2 e +4.
Gruppo 15
Azoto
Gas incolore e toilette. È un po 'di elemento reattivo e leggermente più denso dell'aria. Stati di ossidazione più comuni: -3 e +5. Formare molecole diatomiche, n2.
Incontro
Solido, il suo colore può essere bianco, giallo o nero. Poco reattivo. Struttura cristallina ortorrombica. Elettronegatività 2,1. Stati di ossidazione più comuni: -3 e +5.
Gruppo 16
Ossigeno
Gas incolore o blu pallido, toilette. Generalmente non reattivo. Struttura cristallina cubica. È un isolante e un forte agente ossidante. Elettronegatività 3.5. Stato di ossidazione -2
Zolfo
Solido giallo brillante, fragile, moderatamente reattivo. Struttura cristallina ortorrombica. Formare legami covalenti. Elettronegatività 2.5. Stati di ossidazione più comuni: -2, +2, +4 e +6.
Selenio
Grigio nero o rossastro solido. Il selenio grigio mostra conduttività elettrica sensibile alla luce. È un solido morbido e fragile. Elettronegatività 2.4. Stati di ossidazione: -2, +2, +4 e +6.
Può servirti: idrossido di potassio: struttura, proprietà, usiGruppo 17
Fluoro
È un gas giallo pallido, molto tossico. È un elemento molto reattivo. È presentato come molecole diatomiche, f2. In stato solido cristallizza in forma cubica. Elettronegatività 3.98. Ossidazione degli Stati -1.
Cloro
È un gas giallo verde. Presenta molecole diatomiche, CL2. È molto reattivo. A stato solido la struttura cristallina è ortorrombica. Elettronegatività 3.0. Stati di ossidazione: - 1, +1, +3, +5, +7.
Bromo
È un fluido rosso-gafé. Elettronegatività 2.8. Stati di ossidazione -1, +1, +3, +5 e +7.
Iodio
È un solido nero che quando è sublimati emette un vapore viola. Struttura cristallina ortorrombica. Iodidi metallici sono ionici. Elettronegatività 2.5. Stati di ossidazione: -1, +1, +3, +5, y +7.
Astato
È un solido nero. Struttura cristallina cubica centrata sul viso. Elettronegatività 2,2. È un agente ossidante debole.
Gruppo 18
Elio
Ha un'alta conducibilità termica. Elettronegatività 5.5. È chimicamente inerte e non infiammabile. Bassa densità e alta fluidità.
Neon
Alta capacità di raffreddamento in stato liquido. Elettronegatività 4.84. È il meno reattivo dei gas nobili.
Argon
È più denso dell'aria. Chimicamente inerte. Elettronegatività 3.2.
Krypton
Elettronegatività 2.94. Può reagire con il fluoruro per formare Crypton Difluoride (KRF2).
Xeno
Attraversa la barriera cerebrale del sangue. Risponde alla corrente elettrica che produce luce. Elettronegatività 2,2. Forma complessa con fluoro, oro e ossigeno.
Radon
È un elemento radioattivo. Elettronegatività 2.06. Formare composti con fluoro (RNF2) e con ossigeno (RNO3).
Applicazioni
Idrogeno

È usato nella propulsione a razzo e come combustibile nei motori auto che utilizzano idrogeno. È usato nella sintesi dell'ammoniaca (NH3) e nell'idrogenazione dei grassi.
Carbonio
La grafite viene utilizzata nella produzione di matite e fibre ad alta resistenza che vengono utilizzate nell'elaborazione di articoli sportivi. Il diamante viene usato come un gioiello di grande valore e nelle trapani come abrasivi. L'anidride carbonica viene utilizzata nell'elaborazione delle bevande analcoliche.
Azoto
È usato nella produzione di ammoniaca, acido nitrico e urea. L'azoto è un elemento essenziale per le piante e viene utilizzato nella produzione di fertilizzanti.
Incontro
Il fosforo bianco è usato come raticide, insetticida e nell'industria pirotecnica. Il fosforo rosso viene utilizzato nella produzione di partite. I suoi composti sono anche usati nell'elaborazione dei fertilizzanti.
Ossigeno
L'ossigeno viene utilizzato nell'elaborazione di acciaio, materie plastiche e tessuti. Viene anche utilizzato in razzo, terapia di ossigeno e assistenza respiratoria in aerei, sottomarini e voli spaziali.
Può servirti: erbio: struttura, proprietà, ottenimento, usiZolfo
È usato come materia prima per la produzione di acido solforico, polvere da sparo e nella vulcanizzazione delle gomme. I solfiti vengono usati per candeggiare la carta e il fungicida.
Selenio
È usato per impartire una colorazione rossa scarlatta al vetro. Viene anche usato per neutralizzare la sfumatura verdastra prodotta dall'inquinamento del vetro con composti di ferro. È usato in celle fotoelettriche con applicazione su porte ed elevatori.
Fluoro

Viene aggiunto alle creme dentali per prevenire la carie. Il fluoruro di idrogeno viene utilizzato come materia prima per teflon. Il fluoro monoatomico viene utilizzato nella produzione di semiconduttori.
Cloro
È usato nella metallurgia estrattiva e nella clorazione idrocarbura per la produzione di prodotti diversi come PVC. Il cloro viene utilizzato in legno e tessile Pulp Bleaching. Viene anche usato come disinfettante dell'acqua.
Bromo
È usato nella preparazione di bromuro d'argento per lenti sensibili alla luce e nei film fotografici è anche usato nell'elaborazione del bromuro di sodio sedativo e del dibrometano, un componente anti -dominio della benzina.
Iodio
Lo ioduro di potassio (KI) viene aggiunto per prevenire il gozzo tiroideo. La tintura di iodio è usata come antisettica e germicida. Iodio fa parte degli ormoni tiroidei.
Elio
È usato nel riempimento di mongolfiere e mescolato con ossigeno per la respirazione delle acque profonde. Viene utilizzato per le saldature in un'atmosfera inerte e aiuta a mantenere temperature di ricerca molto basse.
Neon
In tubi di vetro che si illuminano per l'azione dell'elettricità (luci rosse al neon).
Argon
Viene utilizzato per creare un'atmosfera per la saldatura e nel riempimento dei riflettori di incandescenza.
Xeno
Una miscela di xeno e Crypton viene utilizzata nella produzione di lampi di grande intensità nella mostra fotografica a breve termine.
Radon
È usato nel trattamento dei tumori cancerosi mediante radioterapia.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Mathews, c. K., Van Holde, K. E. E Ahern, K. G. (2002). Biochimica. Terza edizione. Modificare. Pearson-Addison Wesley
- Helmestine, Anne Marie, PH.D. (6 ottobre 2019). Quali sono le proprietà dei non metalli? Recuperato da: Thoughtco.com
- Wikipedia. (2019). Metalloide. Recuperato da: in.Wikipedia.org
- I redattori di Enyclopedia Britannica. (5 aprile 2016). Metalloide. Encyclopædia Britannica. Recuperato da: Britannica.com
- Jose m. Gavira Vallejo. (27 gennaio 2016). Cosa sono i pnicogeni? E gli icosogenos, i cristalli, i calcogeni .. ? Estratto da: Triplenlace.com

