Storia, proprietà, struttura, ottenimento del fluorescente
- 1122
- 140
- Brigitta Ferrari
Lui fluoro È un elemento chimico rappresentato con il simbolo F e il gruppo Heads 17, a cui appartengono gli alogeni. Si distingue sopra gli altri elementi della tavola periodica, per essere il più reattivo ed elettronegativo; reagisce quasi con tutti gli atomi, quindi forma innumerevoli sali e composti organizzativi.
In condizioni normali è un gas giallo pallido, che può essere confuso con il verde giallastro. In stato liquido, mostrato nell'immagine inferiore, il suo colore giallo si intensifica un po 'di più, il che scompare completamente quando si solidifica nel suo punto di congelamento.
 Fluoro liquido in un tubo di prova. Fonte: Fulvio314 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Fluoro liquido in un tubo di prova. Fonte: Fulvio314 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] È tale reattività, nonostante il volatile del suo gas, che rimane catturato nella crosta terrestre; Soprattutto sotto forma di minerale di fluoriti, noto per i suoi cristalli viola. Allo stesso modo, la sua reattività lo rende una sostanza potenzialmente pericolosa; reagire vigorosamente con tutto ciò che tocca e brucia in fiamme.
Tuttavia, molti dei suoi prodotti derivati possono essere innocui e persino vantaggiosi, a seconda delle loro applicazioni. Ad esempio, l'uso più popolare del fluoro, aggiunto nella sua forma ionica o minerale (come i sali di fluoro), consiste nella preparazione di paste dentali con fluoro, che aiutano a proteggere lo smalto dentale.
Il fluoro presenta la peculiarità che alti numeri o stati di ossidazione possono stabilizzarsi per molti altri elementi. Maggiore è il numero di atomi di fluoro, più è reattivo il composto (a meno che non sia un polimero). Allo stesso modo, i suoi effetti con matrici molecolari aumenteranno; per il meglio o il peggio.
[TOC]
Storia
Uso del fluorescente
Nel 1530, il mineralogista tedesco Georgius Agricola scoprì che il minerale di fluerspar poteva essere usato nella purificazione dei metalli. Il fluorspar è un altro nome per fluorite, un minerale di fluoro che consisteva in fluoruro di calcio (CAF2).
L'elemento fluoro non era stato scoperto da allora e il "fluoir" nella fluorescente proveniva dalla parola latina "flure" che significa "flusso"; Dal momento che questo era ciò che il fluorspar o il fluorite ha fatto con i metalli: li ha aiutati a lasciare il campione.
Preparazione dell'acido fluorico
Nel 1764, Andreas Sigismud Margraff è gestito. Il vetro ritorna sciolto dall'azione dell'acido, quindi il vetro è stato sostituito dai metalli.
È anche attribuito a Carl Scheele nel 1771, la preparazione dell'acido con lo stesso metodo seguito da Margraff. Nel 1809, la scienziata francese Andre-Marie Ampere propose che l'acido fluorico o fluorico era un composto formato dall'idrogeno e un nuovo elemento simile al cloro.
Gli scienziati hanno cercato di isolare il fluoro attraverso l'uso di acido fluororico per lungo tempo; Ma il suo pericolo ha fatto progressi al riguardo.
Humphry Davy, Joseph Louis Gay-Lussac e Jacques Thénard hanno avuto un forte dolore quando inalava il fluoruro di idrogeno (acido fluoruro senza acqua e in forma gassosa)). In circostanze simili, gli scienziati Paulin Louyet e Jerome Nickles sono morti per avvelenamento.
Edmond Fréme, ricercatore francese, ha cercato di creare acido fluoride secco per evitare la tossicità del fluoruro di idrogeno mediante acidificazione del bifluoruro di potassio (KHF2), Ma durante l'elettrolisi non vi era alcuna conduzione della corrente elettrica.
Isolamento
Nel 1860, il chimico inglese George Gore ha provato. Tuttavia, c'è stata un'esplosione ricombando violentemente l'idrogeno con fluoruro. Gore attribuì l'esplosione a una perdita di ossigeno.
Nel 1886, il chimico francese Henri Moisson riuscì a isolare il fluoruro per la prima volta. In precedenza, il lavoro di Moisson è stato interrotto quattro volte a causa di un serio avvelenamento con fluoruro di idrogeno, mentre cercava l'isolamento dell'elemento.
Moisson era uno studente di frutto e si basava sui suoi esperimenti per isolare il fluoruro. Moisson usato nell'elettrolisi una miscela di fluoruro di potassio e acido fluorrotto. La soluzione risultante LED elettricità e gas fluoro si sono accumulati nell'anodo; cioè, nell'elettrodo caricato positivamente.
Moisson usava un'attrezzatura resistente alla corrosione, in cui gli elettrodi erano fatti di una lega di platino e iridio. Nell'elettrolisi utilizzava un contenitore platino e raffreddava la soluzione elettrolitica a una temperatura di -23 ºF (-31 ºC).
Infine, il 26 giugno 1886, Henri Moisson riuscì a isolare il fluoro, un'opera che gli permise di vincere il premio Nobel nel 1906.
Interesse per il fluoro
Per un po 'l'interesse per le indagini con il fluoro è stato perso. Tuttavia, lo sviluppo del progetto Manhattan per la produzione della bomba atomica.
La società americana DuPont sviluppò, tra il 1930 e il 1940, prodotti fluorurati come clorofluorocarbonati (Freon-12), usati come refrigeranti; e politetrafluoroetilene in plastica, noto meglio con il nome Teflon. Ciò ha prodotto un aumento della produzione e del consumo di fluoro.
Nel 1986, in una conferenza per un secolo di isolamento del fluoro, il chimico americano Karl o. Christe ha presentato un metodo chimico per la preparazione del fluoruro per reazione tra K2Mnf6 e l'SBF5.
Può servirti: alcol polivinilicoProprietà fisiche e chimiche
Aspetto
Il fluoro è un gas giallo pallido. In stato liquido è giallo brillante. Nel frattempo, il solido può essere opaco (alfa) o trasparente (beta).
Numero atomico (Z)
9.
Peso atomico
18.998 u.
Punto di fusione
-219,67 ºC.
Punto di ebollizione
-188.11 ºC.
Densità
A temperatura ambiente: 1.696 g/l.
Al punto di fusione (liquido): 1.505 g/ml.
Calore di vaporizzazione
6,51 kJ/mol.
Capacità calorica molare
31 J/(mol · K).
Pressione del vapore
A una temperatura di 58 K ha una pressione vapore di 986,92 atm.
Conduttività termica
0,0277 W/(M · K)
Ordine magnetico
Diamagnetico
Odore
Odore caratteristico piccante e penetrante, rilevabile anche a 20 ppb.
Numeri di ossidazione
-1, che corrisponde all'anione del fluoruro, f-.
Energia ionizzata
-Primo: 1.681 kJ/mol
-Secondo: 3.374 kJ/mol
-Terzo: 6.147 kJ/mol
Elettronegatività
3.98 su scala pauling.
È l'elemento chimico con il più grande delle elettronegatività; cioè, ha un'alta affinità per gli elettroni degli atomi con cui è collegato. Per questo motivo, gli atomi di fluoro generano grandi momenti di dipolo in regioni specifiche di una molecola.
La sua elettronegatività ha anche un altro effetto: gli atomi legati a lui perdono così tanta densità elettronica che iniziano ad acquisire un carico positivo; Questo è un numero di ossidazione positivo. Più atomi di fluoro in un composto, l'atomo centrale avrà un numero di ossidazione più positivo.
Ad esempio, nel di2 L'ossigeno ha un numero di ossidazione di +2 (o2+F2-); Nell'UF6, L'uranio ha un numero di ossidazione di +6 (u6+F6-); Lo stesso vale per lo zolfo nella SF6 (S6+F6-); E finalmente è l'AGF2, dove l'argento ha anche un numero di ossidazione di +2, insolito in esso.
Pertanto, gli elementi riescono a partecipare con i loro numeri di ossidazione più positivi quando formano composti con fluoruro.
Agente ossidante
Il fluoro è l'elemento ossidante più potente, quindi nessuna sostanza è in grado di ossidarsi; E per questo motivo, non è libero di natura.
Reattività
Il fluoro è in grado di combinarsi con tutti gli altri elementi, tranne con elio, neon e argon. Inoltre non attacca acciaio dolce o rame a temperature normali. Reagire violentemente con materiali organici, come gomma, legno e tessuto.
Il fluoro può reagire con lo xeno del gas nobile per formare il forte ossidante di difluoro dello xeno, XEF2. Reagisce anche con l'idrogeno per formare un alogenuro, fluoruro di idrogeno, HF. A sua volta, il fluoruro di idrogeno viene sciolto in acqua per produrre il famoso acido fluorhorico (vetro mangia).
L'acidità degli acidi idrace, classificati in ordine crescente è:
HF < HCl < HBr < HI
L'acido nitrico reagisce con il fluoruro per formare nitrato di fluoro, FNO3. Nel frattempo, l'acido cloridrico reagisce vigorosamente con il fluoro per formare HF, di2 e clf3.
Struttura elettronica e configurazione

Molecola diatomica
 Molecola di fluoro rappresentato con modello di riempimento dello spazio. Fonte: Gabriel Bolívar.
Molecola di fluoro rappresentato con modello di riempimento dello spazio. Fonte: Gabriel Bolívar. L'atomo di fluoro nel suo stato basale ha sette elettroni di Valencia, che sono negli orbitali 2s e 2p in base alla configurazione elettronica:
[Lui] 2s2 2 p5
La teoria dei collegamenti di Valencia (TEV) stabilisce che due atomi di fluoro, F, sono covalentemente collegati per poter completare il loro ottetto a Valencia ciascuno.
Ciò si verifica rapidamente perché manca a malapena di un elettrone per diventare isolectronico a nobile gas neon; E i suoi atomi sono molto piccoli, con un carico nucleare molto forte che richiede facilmente elettroni dell'ambiente.
La molecola f2 (Immagine superiore), ha un semplice collegamento covalente, F-F. Nonostante la sua stabilità rispetto agli atomi di F liberi, è una molecola estremamente reattiva; Omonucleare, apolare e desideroso di elettroni. Ecco perché fluoruro, come F2, È una specie molto tossica e pericolosa.
Perché il f2 È apolare, le sue interazioni dipendono dalla sua massa molecolare e dalle forze di dispersione di Londra. Ad un certo punto, la nuvola elettronica attorno a entrambi gli atomi di F deve deformarsi e avere origine un dipolo istantaneo che ne induce un altro in una molecola vicina; in modo che siano lentamente e deboli.
Liquido e solido
La molecola f2 È molto piccolo e si diffonde nello spazio con velocità relativa. Nella sua fase gassosa, mostra un colore giallo pallido (che può essere confuso con un verde lime). Quando la temperatura scende a -188 ºC, le forze di dispersione diventano più efficaci e rendono le molecole F2 coesione abbastanza da definire un liquido.
Il fluoro liquido (prima immagine), sembra ancora più giallo del rispettivo gas. In esso, le molecole f2 Sono più vicini e interagiscono con la luce in misura maggiore. È interessante notare che, una volta che il vetro cubico distorto è formato dal fluoro a -220 ºC, il colore svanisce e rimane un solido trasparente.
Può servirti: alcani ramificatiOra che le molecole M2 Sono così vicini (ma senza che le loro rotazioni molecolari si fermino), sembra che i loro elettroni guadagnino una certa stabilità e, quindi, il loro salto elettronico è troppo grande perché la luce persino interagire con il vetro.
Fasi cristalline
Questo cristallo cubico corrisponde alla fase β (non è alotropico perché rimane lo stesso f2). Quando la temperatura scende ancora di più, fino a -228 ºC, il fluoro solido subisce una transizione di fase; Il vetro cubico si trasforma in una fase monoclinica, α:
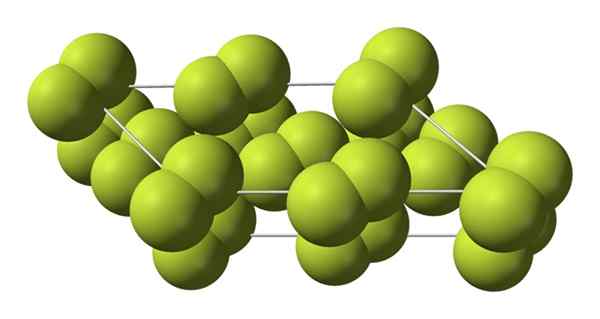
 Struttura cristallina della fase alfa del fluoro. Fonte: Benjah-BMM27 [dominio pubblico].
Struttura cristallina della fase alfa del fluoro. Fonte: Benjah-BMM27 [dominio pubblico]. A differenza di β-F2, Α-F2 è opaco e duro. Forse è perché le molecole M2 Non hanno più tale libertà di ruotare nelle loro posizioni fisse nei cristalli monoclinici; dove interagiscono in misura maggiore con la luce, ma senza eccitare i loro elettroni (che spiegherebbe superficialmente la loro opacità).
La struttura cristallina di α-F2 È stato difficile studiare attraverso metodi di diffrazione di raggi X convenzionali. Questo perché la transizione da fase β a α è molto esotermica; Quindi il cristallo praticamente sfruttava, pur interagendo poco con le radiazioni.
Trascorsero circa cinquant'anni prima degli scienziati tedeschi (Florian Kraus e collaboratori), decifano completamente la struttura α-F2 con maggiore precisione grazie alle tecniche di diffrazione dei neutroni.
Dov'è e ottieni
Il fluoro occupa il 24 ° degli elementi più comuni nell'universo. Tuttavia, sulla terra è in massa il 13vo elemento, con una concentrazione di 950 ppm nella crosta terrestre e una concentrazione di 1,3 ppm nell'acqua di mare.
I terreni hanno una concentrazione di fluoro compresa tra 150 e 400 ppm e su alcuni terreni la concentrazione può raggiungere 1.000 ppm. Nell'aria atmosferica è presente in una concentrazione di 0,6 ppb; Ma si è registrato in alcune città fino a 50 ppb.
Il fluoro è ottenuto principalmente da tre minerali: fluorite o fluorospar (caffè2), Il fluoroapatita [CA5(Po4)3F] e il creolo (na3Alf6).
Elaborazione di fluorite
Dopo aver raccolto le rocce con il minerale fluorescente, queste sono soggette a schiacciamento primario e secondario. Con la frantumazione secondaria di ottenere frammenti di roccia molto piccoli.
Quindi, i frammenti di roccia vengono portati in un mulino a sfera per la riduzione della polvere. Acqua e reagenti vengono aggiunti per formare una pasta, che è collocata in un serbatoio di flottazione. Viene iniettato con pressione per formare bolle, e quindi la fluorite finisce sulla superficie acquosa.
Silicati e carbonati sono sedimenti mentre la fluorite viene raccolta e porta ad asciugare i forni.
Una volta ottenuto il fluorite, viene reagito con acido solforico per produrre fluoruro di idrogeno:
CAF2 + H2SW4 => 2 HF +Caso4
Elettrolisi del fluoruro di idrogeno
Nella produzione di fluoro, vengono seguite alcune modifiche, con il metodo utilizzato da Moisson nel 1886.
Viene prodotta un'elettrolisi di una miscela di fluoruro di potassio fuso e acido floidrico, con un raggio molare di 1: 2,0 a 1: 2,2. La temperatura del sale fuso è di 70 - 130 ºC.
Il catodo è costituito da una lega di monet o in acciaio e l'anodo è di riograttare il carbone. Il processo di produzione di fluoro durante l'elettrolisi può essere schematizzato come segue:
2HF => H2 + F2
L'acqua viene utilizzata per raffreddare la camera di elettrolisi, ma la temperatura deve essere al di sopra del punto di fusione dell'elettrolita per evitare la solidificazione. L'idrogeno prodotto nell'elettrolisi viene raccolto nel catodo, mentre il fluoruro nell'anodo.
Isotopi
Il fluoro ha 18 isotopi, essendo il 19F l'unico isotopo stabile con abbondanza al 100%. Lui 18F ha una mezza vita di 109,77 minuti ed è l'isotopo radioattivo del fluoro con la più grande e mezza vita. Lui 18F è usato come fonte positronica.
Carta biologica
Non è nota alcuna attività metabolica del fluoro nei mammiferi o nelle piante superiori. Tuttavia, alcune piante marine e spugne sintetizzano il monofluroacetato, un composto velenoso, che usa come protezione per evitare la distruzione.
Rischi
Un consumo eccessivo di fluoro è stato associato alla fluorosi ossea negli adulti e alla fluorosi dentale nei bambini, nonché ad alterazioni nel funzionamento renale. Per questo motivo, il Servizio sanitario pubblico degli Stati Uniti (PHS) ha suggerito che la concentrazione di fluoro nell'acqua potabile non dovrebbe essere maggiore di 0,7 mg/L.
Nel frattempo, l'Agenzia di protezione ambientale americana (EPA) ha stabilito che la concentrazione di fluoruro nell'acqua potabile non dovrebbe essere maggiore di 4 mg/l, al fine di evitare la fluorosi scheletrica, in cui il fluoruro si accumula nelle ossa. Ciò può causare indebolimento e fratture ossee.
Il fluoro è stato correlato a danni alla ghiandola paratiroideo, con una diminuzione del calcio nelle strutture ossee e alte concentrazioni di calcio nel plasma.
Può servirti: Living Matter: concetto, caratteristiche ed esempiTra le alterazioni attribuite all'eccesso di fluoro ci sono i seguenti: fluorosi dentale, fluorosi scheletrica e danno alla ghiandola paratiroide.
Fluorosi dentale
La fluorosi dentale è presentata con piccole strisce o motociclette nello smalto dei denti. I bambini sotto i 6 anni non devono usare collutorio contenente fluoro.
Fluorosi scheletrica
Nella fluorosi scheletrica, è possibile diagnosticare il dolore e il danno, nonché nelle articolazioni. L'osso può indurire e perdere l'elasticità, il che aumenta il rischio di fratture.
Applicazioni
Dentifricio
 Alcuni sali inorganici di fluoro sono usati come additivo nella formulazione di paste dentali, che hanno dimostrato che aiutano a proteggere lo smalto dentale. Fonte: pxhere.
Alcuni sali inorganici di fluoro sono usati come additivo nella formulazione di paste dentali, che hanno dimostrato che aiutano a proteggere lo smalto dentale. Fonte: pxhere. Iniziamo con la sezione degli usi per il fluoro con quello più noto: servire come componente di molte paste dentali. Questo non è l'unico uso in cui si può vedere il contrasto tra la sua molecola F2, estremamente velenoso e pericoloso e anione f-, che a seconda del suo ambiente può essere utile (anche se a volte no).
Quando mangiamo cibo, in particolare i dolci, i batteri li degradano aumentando l'acidità della nostra saliva. Quindi, c'è un punto in cui il pH sia sufficiente per degradare e demineralizzare lo smalto dentale; Idrossiapatite scende "giù".
Tuttavia, in questo processo gli ioni f- Interagisci con CA2+ formare una matrice di fluorapatite; più stabile e duraturo dell'idrossipatite. O almeno, questo è il meccanismo proposto per spiegare l'azione dell'anione fluoruro sui denti. È probabile che sia più complesso e che esista un idrossiapatite-fluorapatite dipendente dal pH.
Questi anioni f- Sono disponibili in papà dentali in sali; come: NAF, SNF2 (Il famoso fluoruro di Stine) e Napof. Tuttavia, la concentrazione di F- Deve essere basso (meno dello 0,2%), poiché altrimenti provoca effetti negativi sul corpo.
Fluorizzazione dell'acqua
Molto simile a come con le paste dentali, sono stati aggiunti sali di fluoro alle fonti di acqua potabile per combattere l'aspetto della carie in coloro che lo bevono. La concentrazione deve essere ancora molto più bassa (0,7 ppm). Tuttavia, questa pratica è generalmente diffidente e controversia, come possibili effetti cancerogeni sono stati attribuiti.
Agente ossidante
Il gas f2 Si comporta come un agente ossidante molto forte. Ciò fa disporre molti composti più di quando esposti all'ossigeno e una fonte di calore. Ecco perché è stato utilizzato nelle miscele di carburante a razzo, in cui possono persino sostituire l'ozono.
Polimeri
In molti usi, i contributi al fluoro non sono dovuti a F2 o f-, ma direttamente ai suoi atomi elettronegativi che fanno parte di un composto organico. Pertanto, nell'essenza di un collegamento C-F.
A seconda della struttura, i polimeri o le fibre con legami C-F sono generalmente idrofobici, quindi non si bagnano o resistono all'attacco dell'acido fluororico; O meglio ancora, possono essere eccellenti isolanti elettrici e materiali utili con cui sono fabbricati oggetti come tubi e giunti. Teflon e Navion sono esempi di questi polimeri fluorurati.
Farmacisti
La reattività del fluoruro è chiamata il suo uso per la sintesi di composti più fluore, organici o inorganici. In quelli organici, in particolare quelli con effetti farmacologici, sostituiscono uno dei loro eteroátomos con gli atomi che gli aumentano (positivamente o negativamente) la sua azione sul loro obiettivo biologico.
Ecco perché nell'industria farmaceutica la modifica di alcuni farmaci è sempre sul tavolo aggiungendo atomi di fluoro.
Molto simile si verifica con erbicidi e fungicidi. Il fluoro in essi può aumentare la loro azione e l'efficacia su insetti e parassiti.
Incisione di vetro
L'acido fluororico, grazie alla sua aggressività con il vetro e la ceramica, è stato usato per registrare pezzi sottili e delicati di questi materiali; Di solito destinato alla produzione di microcomponenti di computer o per lampadine elettriche.
Arricchimento dell'uranio
Uno degli usi più rilevanti del fluoro elementare è aiutare a arricchire l'uranio come 235O. Per fare ciò, i minerali di uranio si dissolvono nell'acido fluorico, producendo UF4. Questo fluoro inorganico reagisce quindi con il F2, Per trasformarsi in UF6 (235Uff6 E 238Uff6).
Successivamente, e attraverso una centrifugazione a gas, il 235Uff6 Si separa da 238Uff6 e poi ossidato e conservato come combustibile nucleare.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Krämer Katrina. (2019). La struttura di fluoro congelata è stata rivista dopo 50 anni. La Royal Society of Chemistry. Recuperato da: Chemistryworld.com
- Wikipedia. (2019). Fluoro. Recuperato da: in.Wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Fluoro. Database PubChem. CID = 24524. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Dottore. Doug Stewart. (2019). Fatti per elementi di fluoro. Chemicool. Recuperato da: Chemicool.com
- Batul Nafisa Baxamusa. (21 febbraio 2018). Gli usi sorprendentemente comuni del fluoro altamente reattivo. Recuperato da: Sciencestruck.com
- Paola Opazo Sáez. (4 febbraio 2019). Fluoruro nel dentifricio: è buono o cattivo per la salute? Recuperato da: nacionfarma.com
- Karl Christe e Stefan Schneider. (8 maggio 2019). Fluoro: elemento chimico. Encyclopædia Britannica. Recuperato da: Britannica.com
- Lentech b.V. (2019). Tabella del periodo: ossigeno. Recuperato da: lentech.com
- Gagnon Steve. (S.F.). L'elemento fluoro. Jefferson Lab. Recuperato da: istruzione.Jlab.org
- The American Cancer Society Medical and Editorial Content Team. (28 luglio 2015). Fluorurazione dell'acqua e rischio di cancro. Recuperato da: cancro.org
- « Caratteristiche scientifiche esatte, cosa studi, esempi
- Nessuna storia di metalli, proprietà, gruppi, usi »

