Numero di coordinamento Cos'è, calcolo, esempi

- 3097
- 80
- Zelida Gatti
Lui Numero di coordinazione È la quantità di atomi, ioni o molecole che interagiscono con un centro in composti di ioni e coordinamento. Questo concetto può anche essere applicato alle molecole, tenendo conto di quanti atomi sono collegati tra loro invece del numero dei loro collegamenti.
Questo numero è importante perché definisce le geometrie dei complessi, le densità delle loro fasi materiali e persino il carattere stereochimico (spaziale) delle loro reattività. Per semplificare la loro definizione, sono considerati un atomo vicino che circonda un centro specifico.
 In un'area di monete possiamo apprezzare ciò che si intende per numero di coordinamento
In un'area di monete possiamo apprezzare ciò che si intende per numero di coordinamento Considera, ad esempio, il pavimento composto da monete di immagine superiore. Tutte le monete hanno le stesse dimensioni e se ognuna è osservata, è circondata da altri sei; cioè hanno sei vicini e quindi il numero di coordinamento (c.N.) Per le monete è 6. Questa stessa idea ora si estende allo spazio tridimensionale.
Se le loro radio sono disuguali, non tutte avranno lo stesso numero di coordinamento. Ad esempio: maggiore è la valuta, più vicini, sarà in grado di interagire con un numero maggiore di monete attorno ad esso. Il contrario accade con piccole monete.
[TOC]
Concetto del numero di coordinamento
RADIO ION VS. Numero di coordinazione
Il numero di coordinamento è il numero di vicini più vicini e che, in linea di principio, interagiscono direttamente con un centro, che è principalmente uno ione metallico. Quindi, mettiamo da parte le monete per considerare invece le sfere.
Questo ione metallico mN+, Dove N È uguale alla sua ossidazione o al numero di Valencia, interagisce con altri vicini (ionici o molecolari) chiamati ligandi. Più alto N (+2, +3, ecc.), più piccolo sarà mN+ E, di conseguenza, i ligandi saranno costretti ad avvicinarsi di più per interagire con MN+.
Può servirti: grasso butirico: ottenere, tipi, composizione, usi, beneficiLa seguente immagine illustra quanto sopra:
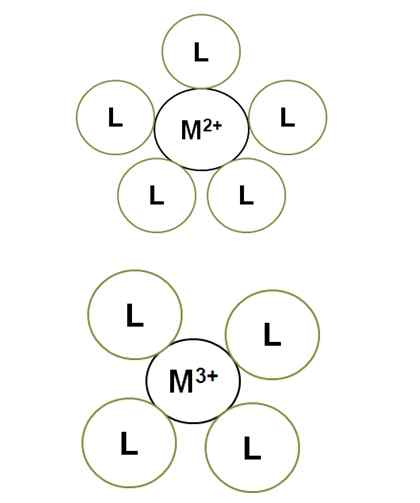 Variazione del numero di coordinamento con il carico di ioni centrali. Fonte: Gabriel Bolívar.
Variazione del numero di coordinamento con il carico di ioni centrali. Fonte: Gabriel Bolívar. M2+ Nel complesso illuminato ha un numero di coordinamento di 5: è circondato da 5 ligandi l. Nel frattempo, m3+ ha un numero di coordinamento 4. Questo perché m3+, Per avere una maggiore entità del carico, i suoi contratti di raggio e, pertanto, i leganti devono avvicinarsi di più, il che aumenta le loro repulsioni elettroniche.
Ecco perché ioni ingombranti centrali, come quelli appartenenti ai metalli a blocchi F, o al secondo o terzo periodo del blocco D, Tendono ad avere numeri di coordinamento più elevati (c.N. > 6).
Densità
Supponiamo ora che il complesso M3+ subisce pressione. Arriverà un punto in cui la pressione sarà tale che un altro collegamento è probabile coordinato o interagerà con M3+. Cioè, il suo numero di coordinamento aumenterà da 4 a 5.
In generale, le pressioni aumentano i numeri di coordinamento, poiché i vicini si costringono a vicenda sullo ione o sull'atomo centrale. Di conseguenza, le fasi materiali di queste sostanze diventano più dense, più compatte.
Geometrie
Illustrazioni superiori non dicono nulla sulle geometrie intorno a m2+ o m3+. Tuttavia, sappiamo che un quadrato ha quattro vertici o angoli, proprio come un tetraedro.
Questo ragionamento si conclude che la geometria intorno a m3+, Di chi c.N. È 4, deve essere tetraedrico o quadrato. Ma quale dei due? Nel frattempo, geometrie per m2+, Di chi c.N. È 5, possono essere una piramide quadrata o bipiramidale trigonale.
Ogni c.N. Ha associato diverse possibili geometrie, che posizionano i leganti a una distanza favorevole, in modo che vi sia la minima repulsione tra di loro.
Può servirti: collegamenti interatomiciCome viene calcolato o determinato il numero di coordinamento?
Il numero di coordinamento può essere calcolato, a volte, direttamente dalla formula composta in questione. Supponiamo che il complesso anionico [Ni (CN)5"3-. Qual è il numero di coordinamento per lo ione di nichel, o2+? È sufficiente osservare il coefficiente stechiometrico 5, il che indica che ci sono 5 anioni CN- coordinato o interagente con il centro di Ni2+.
Tuttavia, non è sempre facile. Ad esempio, il composto CUCN sembra avere un numero di coordinamento di 1 per Cu2+ Per quanto riguarda il CN-. Tuttavia, consiste in effettivamente catene polimeriche Cu-CN-CU-CN, quindi il numero di coordinamento corretto è 2.
Ecco perché il numero di coordinamento è preferibile determinarlo invece di calcolarlo. COME? Determinare le strutture ioniche o molecolari dei composti. Ciò è possibile grazie a tecniche strumentali come diffrazione di raggi X, neutroni o elettroni.
Esempi di numeri di coordinamento
Successivamente e infine alcuni esempi di composti saranno menzionati per ciascuno dei numeri di coordinamento più comuni. Allo stesso modo, si dirà quali sono le loro rispettive geometrie.
C.N. 2
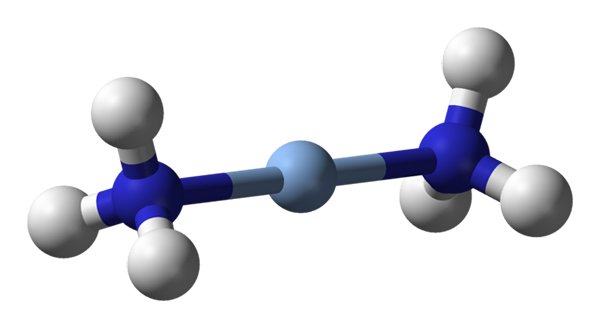 Qui si osserva la geometria lineare di [Ag (NH3) 2]+. Fonte: Benjah-BMM27 / Dominio pubblico
Qui si osserva la geometria lineare di [Ag (NH3) 2]+. Fonte: Benjah-BMM27 / Dominio pubblico AC.N. uguale a 2 significa che l'atomo centrale o l'ione ha solo due vicini. Pertanto, parliamo di composti obbligatoriamente delle geometrie lineari. Tra loro abbiamo:
-Hg (Ch3)2
-[AG (NH3)2"+
-Ph3Paucl
C.N. 3
 Ogni atomo di carbonio in questo foglio di grafite è collegato ad altri tre, quindi ha tre vicini. Fonte: Benjah-BMM27 / Dominio pubblico
Ogni atomo di carbonio in questo foglio di grafite è collegato ad altri tre, quindi ha tre vicini. Fonte: Benjah-BMM27 / Dominio pubblico AC.N. uguale a 3 significa che l'atomo centrale o lo ione è circondato da tre vicini. Abbiamo quindi geometrie come: piano trigonale (triangolare), piramide trigonale e T. Esempi di composti con questo numero di coordinamento sono:
Può servirti: massa atomica: definizione, tipi, come calcolarlo, esempi-[Cu (CN)3"2-
-[PT (PCY3)3], Dove la PCY si riferisce al ligando tricilohexylophospine
-Grafite
C.N. 4
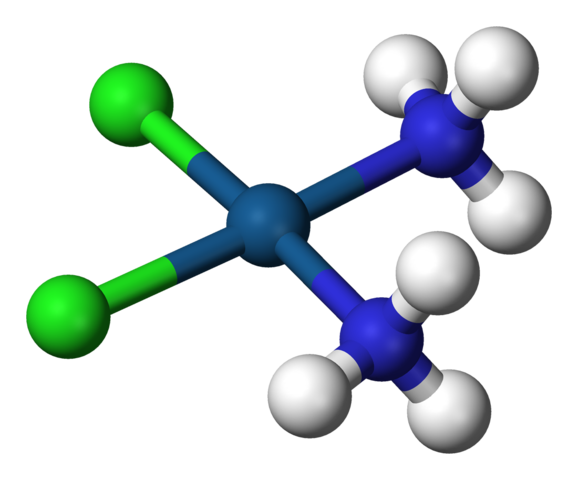 Geometria quadrata di cisplatino, cis-ptcl2 (NH3) 2. Fonte: Benjah-BMM27 / Dominio pubblico
Geometria quadrata di cisplatino, cis-ptcl2 (NH3) 2. Fonte: Benjah-BMM27 / Dominio pubblico AC.N. uguale a 4 significa che l'atomo centrale o lo ione è circondato da quattro vicini. Le sue possibili geometrie sono tetraedriche o quadrate. Esempi di composti con questo numero di coordinamento hanno quanto segue:
-Cap4
-Cocl2Pyr2
-Cis-ptcl2(NH3)2
-[Alcl4"-
-[Muggire4"2-
-Sncl4
-[CRO4"2-
-[MnO4"2-
Tutti questi esempi, ad eccezione del cis-ptcl2(NH3)2, Sono geometrie tetraedriche.
C.N. 5
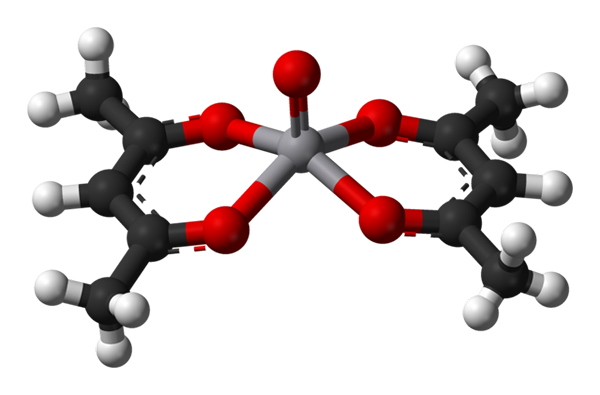 Geometria piramidica quadrata per VO (ACAC) 2. Fonte: Benjah-BMM27 / Dominio pubblico.
Geometria piramidica quadrata per VO (ACAC) 2. Fonte: Benjah-BMM27 / Dominio pubblico. AC.N. uguale a 5 significa che l'atomo o lo ione centrale è coordinato o interagito con cinque vicini. Le sue geometrie, già menzionate, sono la piramide quadrata o bipiramidale trigonale. Come esempi abbiamo quanto segue:
-[Cobrn (CH2Cap2Nme2)3"
-[Fe (CO)5"
-VO (ACAC)2, ACAC è il ligando acetilacetonate
C.N. 6
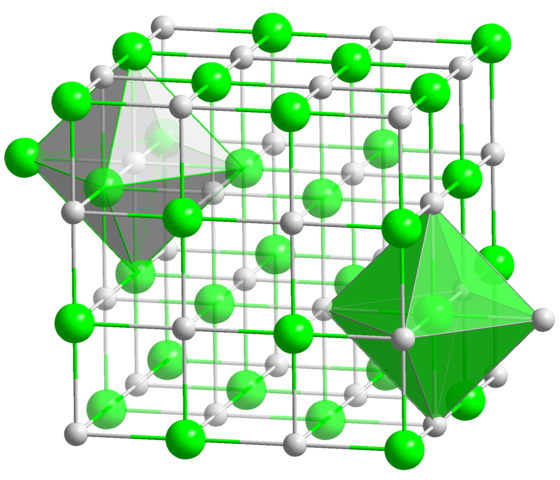 Nella struttura cristallina del NaCl, ogni ione Na+ e cl- hanno sei vicini, quindi questo è il numero di coordinamento per entrambi gli ioni (vedi Octaedra). Fonte: stato solido / dominio pubblico
Nella struttura cristallina del NaCl, ogni ione Na+ e cl- hanno sei vicini, quindi questo è il numero di coordinamento per entrambi gli ioni (vedi Octaedra). Fonte: stato solido / dominio pubblico Questo è di gran lunga il numero di coordinamento più comune tra tutti i composti. Ricorda l'esempio delle monete di principio. Ma invece della sua geometria preferita è quella di un esagono piatto, corrisponde a quello dell'ottaedro (normale o distorto), oltre al prisma trigonale. Alcuni di molti esempi di composti con questo numero di coordinamento sono:
-[Alf6"3-
-[CO (NH3)6"3+
-[ZR (scegli3)6"2-
-NaCl (sì, sale da tavola)
-Mos2, Nota che c.N. Per questo composto non è 2
Altri
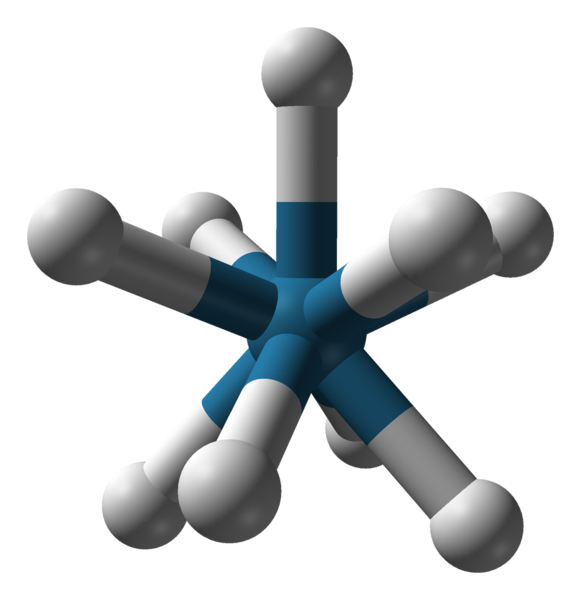 Geometria triapadica triapadica tripade dell'anione [reh9] 2-. Fonte: Benjah-BMM27 / Dominio pubblico.
Geometria triapadica triapadica tripade dell'anione [reh9] 2-. Fonte: Benjah-BMM27 / Dominio pubblico. Ci sono altri numeri di coordinamento, da 7 a 15. In modo che c.N. Sii alto, lo ione centrale o l'atomo deve essere molto grande, avere un carico poco e allo stesso tempo i ligandi devono essere molto piccoli. Alcuni esempi di composti con tale c.N. Sono sotto e per finire:
-K3[Nbof6], C.N. 7 e geometria Octaedro
-[MO (CN)8"3-
-[Zr (bue)4"2-, essere bue il ligando ossalato
-[Reh9"2-
-[Cipiglio3)6"2-, C.N. uguale a 12
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2020). Numero di coordinazione. Recuperato da: in.Wikipedia.org
- I redattori di Enyclopedia Britannica. (S.F.). Numero di coordinazione. Recuperato da: Britannica.com
- Prof. Robert J. Lancashire. (15 agosto 2020). Numeri di coordinamento e geometria. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- Helmestine, Anne Marie, PH.D. (28 agosto 2020). Definizione del numero di coordinamento in chimica. Recuperato da: Thoughtco.com

