Struttura di nitrato d'argento (AGNO3), proprietà, usi, tossicità

- 3974
- 196
- Brigitta Ferrari
Lui nitrato d'argento È un sale inorganico la cui formula chimica è AGNO3. Di tutti i sali d'argento, è il più economico e quello che presenta una relativa stabilità contro la luce solare, quindi tende a decomporre meno. È la fonte d'argento solubile e prediletta in ogni laboratorio di insegnamento o ricerca.
Nell'insegnamento, le soluzioni acquose di nitrati d'argento vengono utilizzate per insegnare reazioni di precipitazione del cloruro d'argento. Allo stesso modo, queste soluzioni sono messe in contatto con il rame metallico per svolgere una reazione di Rédox, in cui il metallo si precipita in argento in metallo in mezzo alla forma formata del nitrato di rame, Cu (no3)2.
 Contenitore campione di nitrato d'argento. Fonte: w. Oelen/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0)
Contenitore campione di nitrato d'argento. Fonte: w. Oelen/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0) Nell'immagine superiore viene mostrata una bottiglia con nitrato d'argento. Può essere tenuto esposto alla luce senza un presto oscuramento dei suoi cristalli, prodotto dell'aspetto dell'ossido d'argento.
Seguendo le usanze alchemiche e le proprietà antibatteriche dell'argento metallico, il nitrato d'argento è stato usato per disinfettare e cauterare le ferite. Tuttavia, a questo scopo vengono utilizzate soluzioni acquose molto diluite o il suo solido miscelato con nitrato di potassio applicato dalla punta delle aste di legno.
[TOC]
Struttura di nitrati d'argento
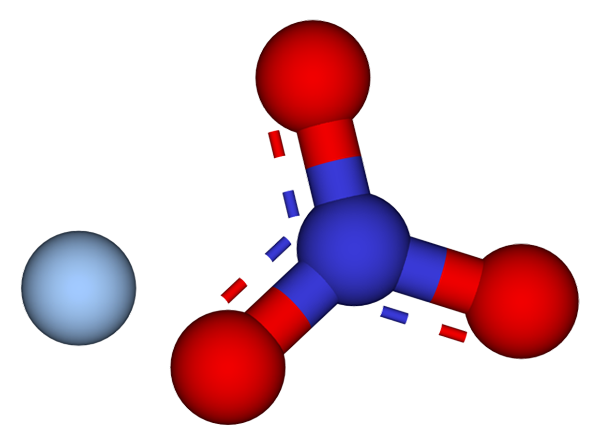 Ioni che compongono i cristalli di nitrato d'argento. Fonte: ccoil/cc BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0)
Ioni che compongono i cristalli di nitrato d'argento. Fonte: ccoil/cc BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0) Nell'immagine superiore gli ioni Ag sono mostrati+ e non3- di nitrato d'argento, che sono rappresentati da un modello di sfere e barre. La formula AGNO3 indica la proporzione stechiometrica di questo sale: per ogni cationag AG+ C'è un anione no3- interagendo con lui elettrostaticamente.
Può servirti: zolfo: storia, proprietà, struttura, ottenimento, usiL'anione no3- (di sfere rosse e bluastre) ha una geometria piatta trigonale, con il carico negativo che democalizza tra i suoi tre atomi di ossigeno. Pertanto, le interazioni elettrostatiche tra i due ioni si svolgono specificamente tra il catione AG+ e un atomo di ossigeno dell'anione no3- (Ag+-O NO2-).
In questo modo, ogni AG+ finisce per coordinare o circondare tre no3- adiacente allo stesso piano o strato cristallografico. Il raggruppamento di questi aerei finisce per definire un cristallo la cui struttura è ortorrombica.
Preparazione
Il nitrato d'argento viene preparato attaccando un pezzo in argento in metallo brunito con acido nitrico, a freddo o a caldo:
3 AG + 4 HNO3 (diluito) → 3 agno3 + 2 h2O +NO
AG + 2 HNO3 (concentrato) → agno3 + H2O +NO2
Nota la formazione di gas no e no2, che sono tossici e forzano questa reazione da non eseguire al di fuori di una campana di estrattore.
Proprietà fisiche e chimiche
Aspetto fisico
Solido cristallino incolore, toilette, ma molto amaro.
Massa molare
169.872 g/mol
Punto di fusione
209,7 ºC
Punto di ebollizione
440 ºC. Tuttavia, a questa temperatura subisce una decomposizione termica, in cui si verifica l'argento di metallo:
2 AGNO3(l) → 2 ag (s) + o2 (g) + 2 no2 (G)
Non ci sono vapori Agno3, Almeno non in condizioni terrestri.
Solubilità
L'agno3 È un risparmio idrico incredibilmente solubile, con una solubilità di 256 g/ 100 ml a 25 ° C. È anche solubile in altri solventi polari come ammoniaca, acido acetico, acetone, etere e glicerolo.
Densità
4,35 g/cm3 a 24 ºC (temperatura ambiente)
Può servirti: acqua distillata3,97 g/cm3 a 210 ºC (proprio al punto di fusione)
Stabilità
L'agno3 È una sostanza stabile ogni volta che viene archiviata correttamente. Non si infiammerà a nessuna temperatura, sebbene possa essere scomposto rilasciando fumi tossici degli ossidi di azoto.
D'altra parte, sebbene il nitrato d'argento non sia infiammabile, è un potente agente ossidante che, quando viene in contatto con la materia organica e una fonte di calore, è in grado di innescare una reazione esotermica ed esplosiva.
Oltre a ciò, questo sale non dovrebbe essere esposto troppo tempo alla luce solare, poiché i loro cristalli sono oscurati a causa della formazione di ossido d'argento.
Usi di nitrato d'argento
Agente precipitante e analitico
Nella sezione precedente, è stata fatta menzione dell'incredibile solubilità dell'AGNO3 In acqua. Ciò implica che gli ioni agricoli+ Si dissolveranno senza alcun problema e saranno disponibili per interagire con qualsiasi ione medio acquoso, come gli anioni alogeni (x = f-, Cl-, Br- e io-).
Argento come Ag+, E dopo l'aggiunta di HNO3 diluito, precipita i fluoruri, i cloruri, i bromuri e gli iodidi presenti, che consistono in solidi bianchi o giallastri:
Ag+(AC) +X-(AC) → AGX (S)
Questa tecnica è molto ricorrente per ottenere alogenuros ed è anche utilizzata in numerosi metodi analitici quantitativi.
Reagente Tollens
L'agno3 Ha anche un ruolo analitico nella chimica organica, in quanto è il reagente principale, accanto all'ammoniaca, per la preparazione del reagente Tollens. Questo reagente viene utilizzato in studi qualitativi che consentono di determinare la presenza di aldeidi e chetoni in un campione problematico.
Sintesi
L'agno3 È un'eccellente fonte di ioni argento solubile. Questo, oltre al suo costo relativo e basso, lo rende un reagente richiesto per innumerevoli sintesi organica e inorganica.
Può servirti: Gibbs Free Energy: unità, come viene calcolato e risolti eserciziQualunque sia la reazione, se hai bisogno di ioni+, Quindi è molto probabile che i prodotti chimici ricordi ad Agno3.
Medicinale
L'agno3 Aveva molta popolarità in medicina prima dell'apparizione di antibiotici moderni. Oggi, tuttavia, è ancora utilizzato per casi specifici, in quanto ha proprietà Caulster e antibatteriche.
Di solito, è mescolato con kno3 Sulla punta delle aste di legno, in modo che sia riservato esclusivamente per usi topici. In questo senso, ha servito per il trattamento di verruche, ferite, chiodi infetti, ulcere in bocca nasale e sanguinamento. La miscela Agno3-Kno3 Cauteriza la pelle che distrugge tessuti e batteri danneggiati.
L'azione battericida dell'agno3 È stato anche usato nella purificazione dell'acqua.
Tossicità ed effetti collaterali
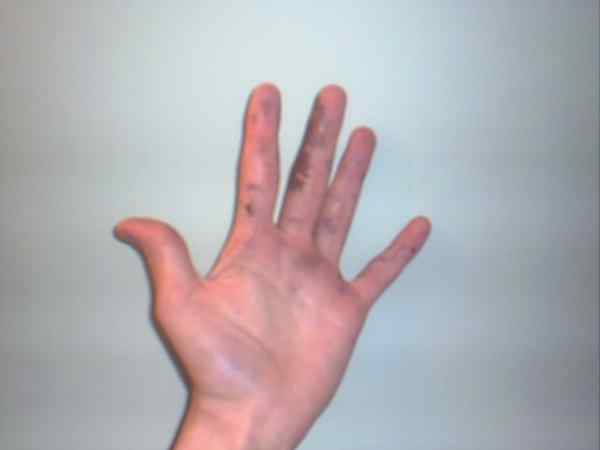 Il nitrato d'argento può causare ustioni che vengono visualizzate dalle loro macchie viola o scure. Fonte: Jane of Baden presso l'inglese Wikipedia / Domina del pubblico
Il nitrato d'argento può causare ustioni che vengono visualizzate dalle loro macchie viola o scure. Fonte: Jane of Baden presso l'inglese Wikipedia / Domina del pubblico Sebbene il nitrato d'argento sia uno stipendio stabile e non rappresenti troppi rischi, è un solido altamente caustico, la cui ingestione può causare gravi danni gastrointestinali.
Ecco perché si consiglia la sua manipolazione con i guanti. Può bruciare la pelle e, in alcuni casi, oscurarla fino a quando non diventa viola, condizione o malattia nota come Argria.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2020). Nitrato d'argento. Recuperato da: in.Wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2020). Nitrato d'argento. Database PubChem., CID = 24470. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Elsevier b.V. (2020). Nitrato d'argento. Scienceirect. Estratto da: ScienceDirect.com
- Università dell'Iowa. (2020). Uso e tossicità dei nitrati d'argento. Recuperato da: medicina.Uiowa.Edu
- P.F. Lindley & p. Woodward. (1966). UN X-RAY Research of Silver Nitrate: una struttura di nitrato in metallo unico. Journal of the Chemical Society A: inorganico, fisico, teorico.
- Lucy Bell Young. (2020). Quali sono gli usi medici del nitrato d'argento. Sostanze chimiche del reagente. Recuperato da: prodotti chimici.co.UK
- « Struttura della piperidina, sintesi, derivati, reazioni
- Cronologia C ++, caratteristiche, tipi di dati, esempi »

