Modifiche postradizionali
- 2047
- 277
- Cosetta Messina
Quali sono le modifiche post -traduzionali?
Le modifiche post -traduzionali sono modificazioni reversibili o irreversibili o alterazioni chimiche.
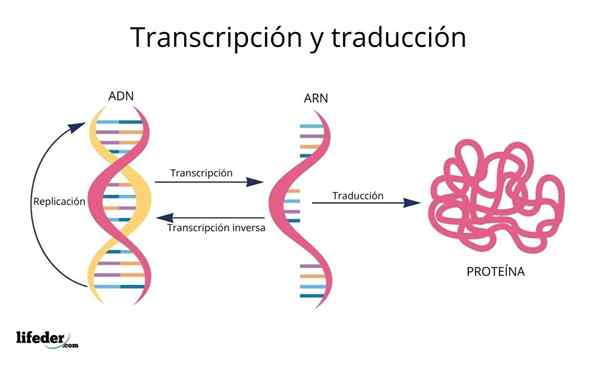
La traduzione è il risultato della "lettura e interpretazione" delle informazioni contenute nei geni trovati nel nucleo eucariotico (si verifica anche nei procarioti).
L'insieme genico di una cellula -genoma- È dove le istruzioni devono produrre tutte le proteine strutturali e gli enzimi che si trovano nell'interno cellulare, da cui dipendono i processi e le funzioni vitali di ciascuna cellula.
I geni sono formati dal DNA (acido deossiribonucleico), che è una macromolecola formata da due catene complementari di un polimero composto da 4 tipi di molecole diverse chiamate basi di azoto, Vale a dire: Adenina, Timina, Guanina e citosina.
Il DNA, quindi, è una specie di alfabeto Con informazioni che vengono lette e tradotte.
Prima della traduzione, le informazioni nel DNA prima sono trascritto All'interno del nucleo a un'altra molecola molto simile, RNA (acido ribonucleico), sotto forma di molecole chiamate molecole RNA Messenger, che vengono successivamente trasportati al citosol.
L'RNA è molto simile al DNA, ma è formato da una singola catena composta da basi di azoto di adenina, uracile, guanina e citosina.
Gli RNA Messenger, derivati dalle sequenze di proteine di codifica genetica, vengono successivamente "letti" e la loro sequenza è tradotto Nelle sequenze peptidiche di proteine cellulari con l'aiuto di ribosomi e altre molecole di RNA note come Trasferisci l'RNA Questo, come suggerisce il nome, Si trasferiscono gli aminoacidi appropriati per la proteina che viene sintetizzata.
L'ordine in cui questi aminoacidi sono aggiunti nelle proteine nascenti è dettato dalla sequenza dei geni che li codificano, cioè dall'ordine delle basi di azoto nella sequenza del DNA.
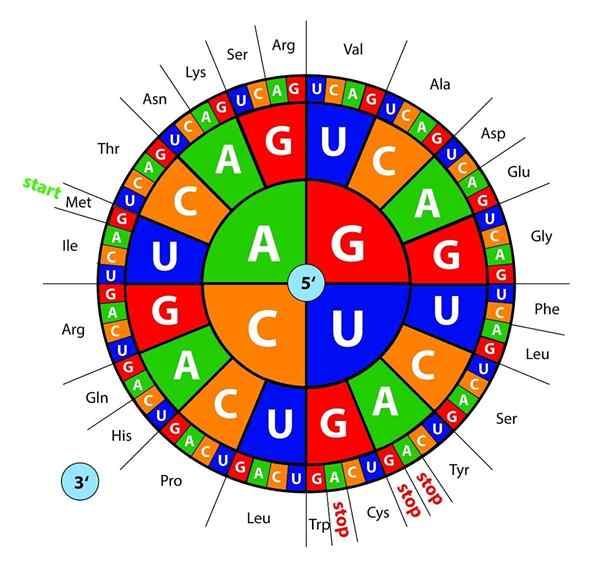
Le basi del DNA, trascritte come RNA, vengono "lette" dai ribosomi in trii o terzine chiamate codoni, ognuno di quelli codifica per uno dei 20 aminoacidi con cui si formano le proteine; Ecco questo codice genetico viene interpretato per introdurre, nel giusto ordine, un aminoacido allo stesso tempo.
Modifiche post -traslazionali
La maggior parte delle caratteristiche fisico -chimiche e funzionali di ciascuna proteina dipendono principalmente dalle informazioni codificate nel DNA.
Tuttavia, le cellule riescono ad aumentare significativamente la diversità delle loro proteine attraverso modifiche post -traduzionali, che non sono altro che modifiche chimiche - mediate dagli enzimi - che soffrono di alcune proteine dopo la loro traduzione.
Può servirti: glucosio ossidasi: caratteristiche, struttura, funzioniPertanto, le caratteristiche di alcune proteine non possono essere dedotte esclusivamente dalla sequenza di aminoacidi che deriva da informazioni genetiche.
Queste modifiche si verificano generalmente sui rifiuti di aminoacidi che fanno.
Sono state descritte più di 500 modifiche post -traduzionali, ma di queste le più note e studiate sono la fosforilazione, la formazione di ponti disolfuro, metilazione, acetilazione, idrossilazione, glicosilazione.
Processo di modifica postradizionale
Le modifiche post -traduzionali, come abbiamo commentato, sono modifiche chimiche che soffrono di proteine cellulari eucariotiche dopo che si è verificata la loro sintesi, cioè la loro traduzione.
Generalmente hanno a che fare con l'aggiunta di gruppi chimici e/o la modifica dei rifiuti di aminoacidi che compongono le proteine, ma alcune importanti modificazioni hanno anche a che fare con la creazione di legami tra aminoacidi della stessa proteina o anche con l'eliminazione di aminoacidi o segni peptidi per tagli o Clivajes proteolitico.
Queste modifiche sono possibili grazie alla presenza di alcuni enzimi cellulari specializzati e, inoltre, substrati di energia di piccole dimensioni - non sono reazioni spontanee - come, ad esempio:
- L'ATP (adenosina 5-fosfato)
- Acetil Coenzyme A (acetil co-A)
- Il NAD+ (5'-nicinamide 5'-difosfato adenosina)
- S-adenosil metionina (Sam)
- L'Uracil 5'-difosfato N-Acetil glucosamina (UDP-GRCNAC)
- Uracil 5'-glucosio difosfato (UDP-glucosio)
- Tra gli altri
Alcune delle modifiche post -traduzionali più importanti agiscono come interruttori (Suiches) Molecolare che attiva o disattiva le funzioni enzimatiche di alcune proteine, regolando la loro funzione cellulare o persino la sua posizione intracellulare.
Ad esempio, molte proteine appartenenti agli organelli intracellulari sono sintetizzate nel citosol con estremità N-o-terminali che corrispondono a Sequenze di segnalazione, che sono riconosciute da altre proteine responsabili di indirizzarle al compartimento appropriato e, lungo la strada, questi segnali vengono generalmente rimossi dalla struttura proteica.
Un altro esempio molto sorprendente di modifiche post -traduzionali che hanno a che fare con il clivaje proteolitico è quello di alcuni ormoni ed enzimi con attività di proteasi, che sono sintetizzate come proteine inattive che necessitano della rimozione proteolitica di alcuni dei loro aminoacidi per diventare le loro forme attive per diventare le loro forme attive per diventare le loro forme attive.
Proteine coniugate
Sebbene non siano sempre riconosciuti come tali, altre modifiche post -traduzionali molto importanti sono quelle che coinvolgono la formazione di proteine la cui struttura è composta da una o più catene peptidiche associate a un composto non proteina, attraverso legami covalenti o interazioni più deboli e transitorio.
Generalmente queste proteine sono classificate in base all'identità della frazione non proteica e richiedono tali porzioni per svolgere le loro funzioni.
Può servirti: agar di sangueQueste frazioni o porzioni sono note come Gruppi protesici E un buon esempio di queste proteine è l'emoglobina, che è accoppiata con un gruppo di Hemo.
Reticolo endoplasmatico in azione
Molte modifiche post -traduzionali iniziano all'interno del reticolo endoplasmatico approssimativo, dove i ribosomi associati traducono proteine mentre vengono inserite nella membrana di questo organello.
Nel reticolo endoplasmatico, molte proteine acquisiscono la loro conformazione strutturale finale: le loro sequenze di segnalazione vengono rimosse, piegate nella forma corretta, si formano ponti disulfur, vengono aggiunti gruppi zuccherati, ecc.
Tipi di modifiche post -traduzionali
Più di 500 tipi di diverse modifiche post -traduzionali sono stati descritti nelle cellule eucariotiche; Il seguente elenco raggruppa alcuni dei più studiati:
-
Fosforilazione
Trasferimento di uno o più gruppi di fosfato da molecole ad alta energia, come ATP, verso il gruppo idrossilico di aminoacidi come serina, treonina e tirosina; È mediato dagli enzimi del gruppo del Proteine degli uomini (Questi fosfati vengono rimossi dagli enzimi fosfatasi).
È importante in numerosi eventi cellulari come divisione, trasduzione del segnale, metabolismo dei carboidrati, crescita cellulare e progresso del ciclo cellulare, tra gli altri.
-
Solfonazione
Questa è l'aggiunta di un gruppo -so3H (solfonico) esclusivamente nello spreco dell'amminoacido tirosina ed è tipico delle proteine o delle proteine transmembrali che sono escrete. È catalizzato dagli enzimi tirosil-solfotransferasi.
È un processo importante per il funzionamento di molti recettori membrani, per alcuni tipi di segnaletica intracellulare, ecc.
-
Formazione del ponte disulfur tra cisteine
Questo processo si verifica tra i residui di cisteina ed è una delle modifiche post -traduzionali più importanti dal punto di vista strutturale. I ponti disolfuri sono stabiliti in organelli come il complesso del Golgi e il reticolo endoplasmatico, che hanno ambienti ossidanti.
Questa modifica post -traslazionale ha a che fare con l'istituzione di una certa configurazione strutturale che di solito è molto importante per l'attività di numerosi enzimi.
-
Metilazione
Consiste nell'aggiunta di gruppi metilici in aminoacidi come lisina, arginina, istidina, glutammina e asparagina (N-metilazione), come aspartato e glutammato (O-metilazione) o come cisteina (S-metilazione).
Si verifica grazie all'azione catalitica degli enzimi noti come n-, o-metiltransferasi. La metilazione della proteina è essenziale per la regolazione della trascrizione genetica a livello di proteina dell'istone, ma ha anche un ruolo inferiore nella trasduzione del segnale.
-
Acetilazione
Implica l'aggiunta di gruppi acetilici ai residui di lisina di alcune proteine. È catalizzato dagli enzimi acetiltransferasi e ha anche funzioni molto importanti dal punto di vista della regolazione dell'espressione genetica (a livello di proteine dell'istone, che si legano al DNA).
-
Idrossilazione
Di solito si verifica nei rifiuti di prolina, lisina e asparagina ed è catalizzato da enzimi idrossilasi dipendenti dal ferro. Gli aminoacidi risultanti, l'idrossipro e l'idrossilisina sono molto importanti per la maturazione di alcune proteine (incluso il collagene) e per alcuni composti antibiotici e antifungini (idrossiasparagina).
-
Glicosilazione
Questa modifica è un processo molto importante per le cellule eucariotiche. Si verifica principalmente su rifiuti di serina e asparagina, ma può verificarsi anche su idrossiprolinine o idrossilisine.
Può servirti: evoluzionismo: origine, darwin, evoluzionismo sociale, lineare e culturaleConsiste nell'aggiunta di molecole di carboidrati alla struttura proteica ed è catalizzato dagli enzimi di glicosiltransferasi e si verifica soprattutto nelle proteine dell'escrezione e in quelle che si trovano sulla superficie cellulare.
-
Prenila
È costituito dal trasferimento di gruppi Isaaprenilos (lipidi) ad alcune proteine. Gli enzimi responsabili sono transrassi specifici per ciascun gruppo.
Questo processo è importante per l'ancoraggio di alcune membrane cellulari di proteina, ma si verifica anche durante la trasduzione del segnale, ecc.
-
Ubiquitinazione
Questa è l'aggiunta covalente di una o più copie del peptide noto come Ubiquitina. Questa aggiunta marca Alle proteine per la degradazione in un complesso proteico noto come proteosoma 26S.
Rappresenta un sistema di regolazione intracellulare molto efficiente ed è responsabile della distruzione delle proteine attraverso un percorso dipendente dall'ATP e con la partecipazione di tre diversi enzimi chiamate E1, E2 ed E3.
Esempi
La fosforilazione e la glicelazione sono due modifiche post -traduzionali estremamente importanti per la vita cellulare. Non solo perché controllano molti processi relativi alla comunicazione e al ciclo cellulare, ma anche perché sono molto comuni tra gli eucarioti.
La proteina p53, ad esempio, è una proteina nota come "soppressore del tumore" che viene utilizzata durante alcuni trattamenti per il cancro. La sua attivazione dipende dall'azione di diverse proteine della chinasi che sono responsabili della fosforilazione della sua estremità N-terminale.
D'altra parte, la superficie cellulare eucariotica contiene un gran numero di glicoproteine (proteine modificate post -traduzionali mediante l'aggiunta di carboidrati).
Molte di queste proteine hanno importanti funzioni nel riconoscimento immunitario, nella migrazione cellulare, nel riconoscimento e nell'unione ai recettori, tra gli altri.
Riferimenti
- Alberts, b., Bray, d., Hopkin, k., Johnson, a. D., Lewis, J., Raff, m.,... e Walter, P. (2015). Biologia cellulare essenziale. Scienze della ghirlanda.
- Cox, m. M., & Nelson, D. L. (2008). Principi di biochimica Lechinger. Wh Freeman.
- Garrett, r. H., & Grisham, C. M. (1999). Biochimica.
- Verde, k. D., & Garneau-Tesodikova, s. (2010). Modifica postranslazionale delle proteine.
- Walsh, c. T., Garneau -Sodikova, s., & Gatto Jr, G. J. (2005). Modifica delle proteine post -traslazionali: la chimica delle diversificazioni del proteoma. Angewandte Chemie International Edition, 44 (45), 7342-7372.