Modello meccanico quantistico dell'atomo
- 1021
- 214
- Cosetta Messina
Qual è il modello meccanico quantistico dell'atomo?
Lui Modello meccanico quantistico dell'atomo Supponiamo che ciò sia formato da un nucleo centrale formato da protoni e neutroni. Gli elettroni, di carico negativo, avvolgono il nucleo in regioni diffuse note come orbitali.
La forma e l'estensione degli orbitali elettronici sono determinati da diverse magnitudini: il potenziale centrale e i livelli quantizzati di energia e il momento angolare degli elettroni.
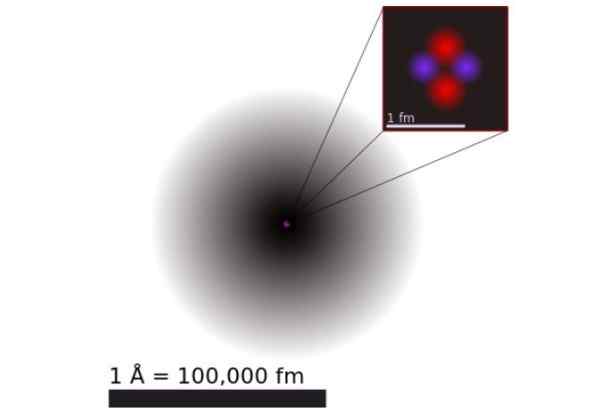
 Figura 1. Modello di un atomo di elio secondo la meccanica quantistica. È costituito dalla nuvola di probabilità dei due elettroni di elio che circondano un nucleo positivo 100 mila volte più piccolo. Fonte: Wikimedia Commons.
Figura 1. Modello di un atomo di elio secondo la meccanica quantistica. È costituito dalla nuvola di probabilità dei due elettroni di elio che circondano un nucleo positivo 100 mila volte più piccolo. Fonte: Wikimedia Commons. Secondo la meccanica quantistica, gli elettroni hanno un comportamento a doppia particella d'onda e la scala atomica sono diffusi e non specifici. Le dimensioni dell'atomo sono praticamente determinate dall'estensione degli orbitali elettronici che circondano il nucleo positivo.
La Figura 1 mostra la struttura dell'atomo di elio, che ha un nucleo con due protoni e due neutroni. Questo nucleo è circondato dalla nuvola di probabilità dei due elettroni che circondano il nucleo, che è di centomila volte più piccolo. Nella seguente immagine puoi vedere l'atomo di elio, con i protoni e i neutroni nel nucleo e negli elettroni negli orbitali.

La dimensione di un atomo di elio è dell'ordine di a Angstrom (1 Å), che è 1 x 10^-10 m. Mentre la dimensione del suo nucleo è dell'ordine di a femtometro (1 FM), che è 1 x 10^-15 m.
Nonostante sia così piccolo comparativamente, il 99,9% del peso atomico è concentrato nel piccolo nucleo. Questo perché i protoni e i neutroni sono 2.000 volte più pesanti degli elettroni che li circondano.
Può servirti: i 31 tipi di forza in fisica e le loro caratteristicheScala atomica e comportamento quantistico
Uno dei concetti che hanno avuto la maggiore influenza sullo sviluppo del modello atomico è stato quello della dualità Onda - particella: La scoperta che ogni oggetto materiale ha un'ondata di materia associata.
La formula che consente di calcolare la lunghezza d'onda λ Associato a un oggetto materiale è stato proposto da Louis de Broglie nel 1924 ed è il seguente:
λ = H / (M V)
Dove H È costante di Planck, M l'impasto e v velocità.
Secondo il principio di De Broglie, ogni oggetto ha un doppio comportamento, ma a seconda della scala di interazioni, velocità e massa, il comportamento delle onde può essere più preminente della particella o viceversa.
L'elettrone è leggero, la sua massa è 9,1 × 10^-31 kg. La velocità tipica di un elettrone è di 6000 km/s (cinquanta volte inferiore alla velocità della luce). Questa velocità corrisponde ai valori energetici nell'intervallo di dozzine di elettroni-voltio.
Con i dati precedenti e utilizzando la formula De Broglie, è possibile ottenere la lunghezza d'onda per l'elettrone:
λ = 6,6 x 10^-34 j s / (9.1 × 10^-31 kg 6 x 10^6 m / s) = 1 x 10^-10 m = 1 Å
L'elettrone alle energie tipiche dei livelli atomici, ha una lunghezza d'onda dello stesso ordine di grandezza di quella della scala atomica, in modo che su quella scala abbia un comportamento ondulatorio e non particelle.
Primi modelli quantici
Con l'idea che l'elettrone su scala atomica abbia un comportamento ondulato, sono stati sviluppati i primi modelli atomici basati su principi quantistici. Tra questi, si distingue il modello atomico di Bohr, che prevedeva perfettamente lo spettro di emissione di idrogeno, ma non quello di altri atomi.
Può servirti: sforzo di tensione: formula ed equazioni, calcolo, eserciziIl modello di Bohr e successivamente quello di Sommerfeld, erano modelli semi-classici. Cioè, l'elettrone era come una particella soggetta alla forza di attrazione elettrostatica del nucleo che orbita attorno ad esso, governata dalla seconda legge di Newton.
Inoltre, alle orbite classiche, questi primi modelli hanno tenuto conto del fatto che l'elettrone aveva un'onda di materiale associata. Solo le orbite il cui perimetro era un intero di lunghezze d'onda, poiché quelle che non soddisfano questo criterio svanivano da interferenze distruttive.
È quindi che la quantizzazione dell'energia nella struttura atomica appare per la prima volta.
La parola Quantico Viene proprio dal fatto che l'elettrone può prendere solo alcuni valori energetici discreti all'interno dell'atomo. Ciò coincide con la scoperta di Planck, che consisteva nella scoperta che una radiazione di frequenza F Interagire con la materia in pacchetti energetici E = H f, Dove H È costante di Planck.
Forma e dimensione orbitale
L'ambito radiale dell'orbitale è determinato dal Funzione d'onda dei raggial. È maggiore nella misura in cui l'energia dell'elettrone cresce, cioè nella misura in cui il numero quantico principale aumenta.
La distanza radiale viene generalmente misurata nelle radio bohr, che per l'energia idrogeno più bassa è 5,3 x 10-11 m = 0,53 Å.
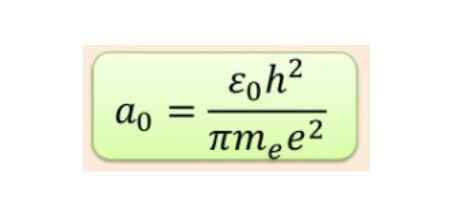 figura 2. Formula del raggio Bohr. Fonte: f. Zapata.
figura 2. Formula del raggio Bohr. Fonte: f. Zapata. Ma la forma degli orbitali è determinata dal valore del numero quantico di motostum angolare. Se l = 0 hai un orbitale sferico chiamato s, se l = 1 hai un orbitale lobed chiamato P, che possono avere tre orientamenti in base al numero quantico magnetico. La figura seguente mostra la forma degli orbitali.
Può servirti: magnitudo vettore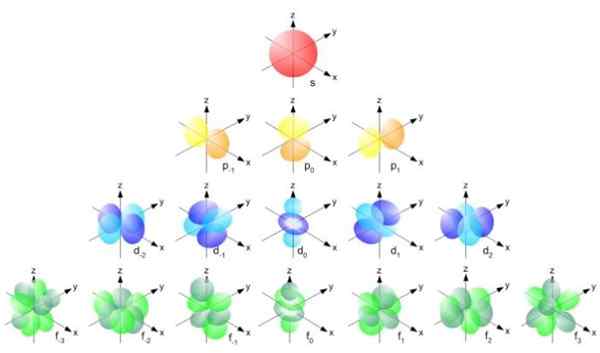 Figura 3. Forma degli orbitali s, p, d, f. Fonte: Ucdavis Chemwiki.
Figura 3. Forma degli orbitali s, p, d, f. Fonte: Ucdavis Chemwiki. Questi orbitali sono confezionati all'interno di altri in base all'energia degli elettroni. Ad esempio, la figura seguente mostra gli orbitali in un atomo di sodio.
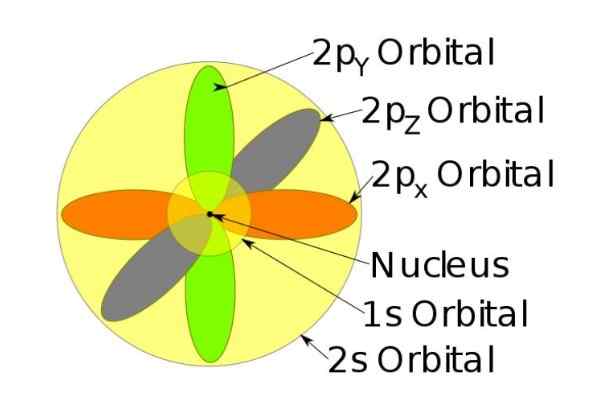 Figura 4. Orbitali 1s, 2s, 2p dello ione di sodio quando ha perso un elettrone. Fonte: Wikimedia Commons.
Figura 4. Orbitali 1s, 2s, 2p dello ione di sodio quando ha perso un elettrone. Fonte: Wikimedia Commons. Lo spin
Il modello meccanico quantico dell'equazione di Schrödinger non incorpora la rotazione dell'elettrone. Ma Pauli è preso in considerazione attraverso il principio di esclusione, il che indica che gli orbitali possono popolare fino a due elettroni con numeri di spin quantistici S = +½ e S = -½.
Ad esempio, lo ione di sodio ha 10 elettroni, cioè se ci riferiamo alla figura precedente, ci sono due elettroni per ciascun orbitale.
Ma se è l'atomo di sodio neutro, ci sono 11 elettroni, l'ultimo dei quali occuperebbe un orbitale 3S (non mostrato nella figura e di raggio maggiore rispetto ai 2s). Lo spin dell'atomo è decisivo nelle caratteristiche magnetiche di una sostanza.
Riferimenti
- Alonso - Finn. Fondamenti quantici e statistici. Addison Wesley.
- Eisberg - Resnick. Fisica quantistica. Limusa - Wiley.
- GasioRowicz. Fisica quantistica. John Wiley & Sons.
- HSC. Corso di fisica 2. Jacaranda Plus.
- Wikipedia. Modello atomico di Schrodinger. Recuperato da: Wikipedia.com

