Modello atomico Heisenberg
- 1118
- 103
- Ruth Cattaneo
Qual è il modello atomico di Heisenberg?
Lui Modello atomico Heisenberg (1927) introduce il principio di incertezza negli orbitali di elettroni che circondano il nucleo atomico. L'eccezionale fisico tedesco ha stabilito le basi della meccanica quantistica per stimare il comportamento delle particelle subatomiche che compongono un atomo.
Il principio di incertezza di Werner Heisenberg indica che non è possibile conoscere con certezza la posizione lineare di un elettrone allo stesso tempo. Lo stesso principio si applica alle variabili del tempo e dell'energia; Cioè, se abbiamo un'indicazione sulla posizione dell'elettrone, ignoreremo il momento lineare dell'elettrone e viceversa.
In breve, non è possibile prevedere simultaneamente il valore di entrambe le variabili. Quanto sopra non implica che nessuna delle magnitudini precedentemente menzionate non possa essere conosciuta con precisione. Ogni volta che è separatamente, non vi è alcun impedimento per ottenere il valore di interesse.
Tuttavia, l'incertezza avviene quando si tratta di conoscere contemporaneamente due magnitudini coniugate, come nel caso della posizione lineare e del momento.
Questo principio nasce a causa di un ragionamento strettamente teorico, come unica spiegazione praticabile per dare motivo di osservazioni scientifiche.
Caratteristiche del modello atomico Heisenberg
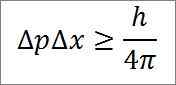 Werner Heisenberg
Werner Heisenberg Nel marzo 1927 Heisenberg pubblicò il suo lavoro Sul contenuto percettivo della cinema e della meccanica quantistica, dove ha dettagliato il principio di incertezza o indeterminatezza.
Questo principio, fondamentale nel modello atomico proposto da Heisenberg, è caratterizzato da quanto segue:
- Il principio di incertezza nasce come una spiegazione che completa le nuove teorie atomiche sul comportamento degli elettroni. Nonostante l'utilizzo di strumenti di misurazione con alta precisione e sensibilità, l'indeterminatezza è ancora presente in qualsiasi prova sperimentale.
- A causa del principio di incertezza, quando si analizza due variabili correlate, se hai una conoscenza accurata di una di queste, allora l'indeterminatezza sul valore dell'altra variabile aumenterà.
- Il momento lineare e la posizione di un elettrone, o di un'altra particella subatomica, non possono essere misurati contemporaneamente.
- La relazione tra le due variabili è data da una disuguaglianza. Secondo Heisenberg, il prodotto delle variazioni del momento lineare -3. 4 Jules x Seconds) e 4π, come dettagliato nella seguente espressione matematica:
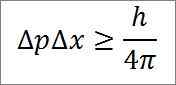
La leggenda corrispondente a questa espressione è la seguente:
∆P: indeterminazione del momento lineare.
∆x: indeterminazione della posizione.
H: costante della tavola.
π: numero PI 3.14.
- Alla luce di quanto sopra, il prodotto delle incertezze ha come arresto inferiore la relazione h/4π, che è un valore costante. Pertanto, se una delle magnitudini tende a zero, l'altra deve aumentare nella stessa proporzione.
- Questa relazione è valida per tutte le coppie di magnitudini canoniche coniugate. Ad esempio: il principio di incertezza di Heisenberg è perfettamente applicabile al duo di energia, come dettagliato di seguito:
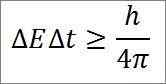
In questa espressione:
∆E: indeterminatezza energetica.
∆T: indeterminazione del tempo.
H: costante della tavola.
π: numero PI 3.14.
- Da questo modello segue che il determinismo causale assoluto nelle variabili canoniche coniugate è impossibile, poiché stabilire questa relazione, dovrebbe essere stabilita la conoscenza dei valori iniziali delle variabili di studio.
- Di conseguenza, il modello Heisenberg si basa su formulazioni probabilistiche, a causa della casualità che esiste tra le variabili a livelli subatomici.
Test sperimentali
Il principio di incertezza di Heisenberg nasce come l'unica spiegazione possibile ai test sperimentali che hanno avuto luogo durante i primi tre decenni del 21 ° secolo.
Prima che Heisenberg abbia enunciato il principio di incertezza, i precetti in vigore hanno suggerito che le variabili del momento lineare, il momento angolare, il tempo, l'energia, tra gli altri, per le particelle subatomiche sono state definite in modo operativamente definite.
Ciò significava che erano trattati come se fossero fisica classica; Cioè, è stato misurato un valore iniziale e il valore finale è stato stimato in base alla procedura pre -stabilita.
Può servirti: magnitudo vettoreQuanto sopra significava definire un sistema di riferimento per le misurazioni, lo strumento di misurazione e la forma di utilizzo di detto strumento, secondo il metodo scientifico.
Secondo questo, le variabili descritte dalle particelle subatomiche dovevano comportarsi in modo determinante. Cioè, il suo comportamento dovrebbe essere previsto esatto e precisamente.
Tuttavia, ogni volta che veniva eseguito un saggio di questa natura, era impossibile ottenere nella misurazione il valore stimato teoricamente.
Le misure sono state travisate a causa delle condizioni naturali dell'esperimento e il risultato ottenuto non è stato utile per arricchire la teoria atomica.
Esempio
Ad esempio: se si tratta di misurare la velocità e la posizione di un elettrone, l'assemblaggio dell'esperimento deve contemplare lo scontro di un fotone di luce con l'elettrone.
Questa collisione induce una variazione della velocità e della posizione intrinseca dell'elettrone, in modo che l'oggetto della misurazione sia alterato da condizioni sperimentali.
Pertanto, il ricercatore incoraggia il verificarsi di un inevitabile errore sperimentale, nonostante l'accuratezza e la precisione degli strumenti utilizzati.
Meccanica quantistica diversa dalla meccanica classica
Oltre a quanto sopra, il principio di indeterminatezza di Heisenberg afferma che, per definizione, la meccanica quantistica funziona in modo diverso rispetto alla meccanica classica.
Di conseguenza, si presume che la conoscenza precisa delle misure subatomiche sia limitata dalla linea sottile che separa la meccanica classica e quantistica.
Limitazioni del modello di Heisenberg
Nonostante spieghi l'indeterminatezza delle particelle subatomiche e sedesse le differenze tra la meccanica classica e quantistica, il modello atomico di Heisenberg non stabilisce un'equazione unica per spiegare la casualità di questo tipo di fenomeni.
Può servirti: energia gravitazionale: formule, caratteristiche, applicazioni, eserciziInoltre, il fatto che la relazione sia stabilita attraverso una disuguaglianza implica che la gamma di possibilità per il prodotto di due variabili canoniche coniugate è indeterminata. Di conseguenza, l'incertezza inerente ai processi subatomici è significativa.
Articoli di interesse
Modello atomico di Schrödinger.
Broglie Atomic Model.
Modello atomico di Chadwick.
Modello atomico Perrin.
Modello atomico Thomson.
Modello atomico Dalton.
Modello atomico di Dirac Jordan.
Modello atomico di Democrito.
Modello atomico Leucipo.
Modello atomico Bohr.
Modello atomico Sommerfeld.
Modello atomico attuale.
Riferimenti
- Beyler, r. (1998). Werner Heisenberg. Encyclopædia Britannica, Inc. Recuperato da: Britannica.com
- Il principio di incertezza di Heisenberg.F.). Recuperato da: Hiru.EUS
- Garcia, J. (2012). Principio di incertezza di Heisenberg. Recuperato da: Hiberus.com
- Modelli atomici (s.F.). Università autonoma nazionale del Messico. Città del Messico, Messico. Recuperato da: Advisory.Cuautitlan2.UNAM.MX
- Werner Heisenberg (s.F.).Estratto da: The-story-Off-the-atom.Wikispaces.com
- Wikipedia, Free Encyclopedia (2018). Plancia costante. Recuperato da: è.Wikipedia.org
- Wikipedia, Free Encyclopedia (2018). Relazione indeterminata di Heisenberg. Recuperato da: è.Wikipedia.org

