Mioglobina

- 4099
- 1039
- Enzo De Angelis
 Struttura di mioglobina
Struttura di mioglobina Cos'è Myoglobin?
IL Mioglobina È una proteina globulare intracellulare che si trova nel citosol delle cellule muscolari scheletriche e cardiache. La sua funzione fondamentale è quella di costituire una riserva di ossigeno e favorire il trasporto intracellulare di ossigeno.
John Kendrew e Max Perutz hanno ricevuto il premio Nobel in chimica nel 1962 per i loro studi sulle proteine globulari. Questi autori chiariscono la struttura tridimensionale di mioglobina ed emoglobina, rispettivamente. Storicamente la mioglobina era una delle prime proteine di cui è stata determinata la struttura tridimensionale.
Le proteine globulari sono molecole compatte con una forma sferica; Sono solubili in citosol o nella parte lipidica delle membrane cellulari. Sono responsabili delle principali azioni biologiche, al contrario delle proteine fibrose, le cui funzioni principali sono strutturali.
La mioglobina dà la carne fresca di rosso. Ciò si verifica quando la mioglobina viene ossigenata come ossimioglobina e il ferro che lo compone è in ferro ferroso: MB-FE2+O2.
Quando la carne è esposta all'ambiente, ferrosa, instabile, ossidata e diventa ferrica e in queste condizioni il colore cambia ai toni marroni per la formazione di metamioglobina (MB-FE3 + + O2 ●-).
Normalmente i livelli di myglobina nel sangue sono molto piccoli, sono nell'ordine dei microgrammi per litro (μg/L). Questi livelli aumentano quando la distruzione muscolare si verifica come nella rabdomiolisi del muscolo scheletrico o in caso di infarto cardiaco con la distruzione dei tessuti e in alcune miopatie.
La sua presenza nelle urine è osservata in determinate condizioni in cui il danno tissutale è molto importante. Il suo valore diagnostico precoce per l'infarto cardiaco è discutibile.
Può servirti: core cellulareStruttura di mioglobina
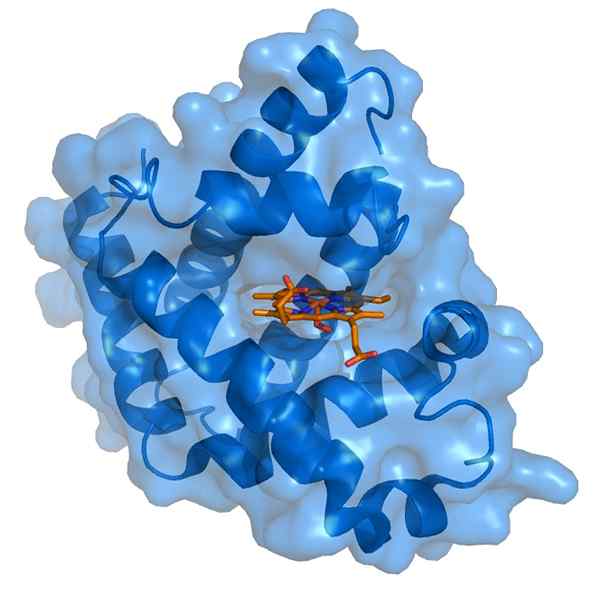 Myoglobin e il suo gruppo di protesi emo (fonte: Thomas Spletttsser/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0) via Wikimedia Commons)
Myoglobin e il suo gruppo di protesi emo (fonte: Thomas Spletttsser/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0) via Wikimedia Commons) La mioglobina ha un peso molecolare di quasi 18 kDa incluso il gruppo Hemo. È composto da quattro segmenti elicoidali uniti da "giri improvvisi". Queste eliche di mioglobina sono strettamente confezionate e mantengono la loro integrità strutturale anche quando il gruppo Hemo viene rimosso.
La struttura delle proteine globulari, così come tutte le proteine cellulari, è gerarchica, quindi la struttura della mioglobina è anche. Il primo livello è la struttura primaria formata dalla sequenza lineare di aminoacidi e mioglobina è costituita da una catena di aminoacidi 153.
La struttura secondaria della mioglobina consiste nella formazione dell'elica alfa. La mioglobina contiene 8 eliche alfa formate da ripetute porzioni polipeptidiche che si legano da segmenti di gestione aperta a breve.
La struttura terziaria è costituita da una conformazione tridimensionale con l'attività biologica. Le caratteristiche più importanti di questa struttura sono pieghevoli. La struttura quaternaria si riferisce all'assemblaggio di due o più catene polipeptidiche separate e unite attraverso collegamenti o interazioni non covalenti.
La mioglobina ha una struttura molto compatta, con rifiuti idrofobici diretti verso residui interni e idrofili o polari diretti verso l'esterno. I rifiuti apolari interni sono formati da leucina, valina, metodo e fenilalanina. L'unico rifiuto polare interno sono due istidine che hanno funzioni nel centro attivo.
Il gruppo di protesi emo si trova in una fessura della parte interna apolare della catena del polipeptide di poliloglobina. Questo gruppo contiene ferro sotto forma di ferro ferroso, che si lega all'ossigeno per formare ossimioglobina.
Può servirti: Glut4: caratteristiche, struttura, funzioniFunzione mioglobina
La funzione della mioglobina è quella di unire l'ossigeno al gruppo Hemo della sua struttura e formare una riserva di ossigeno per la funzione muscolare. Nella misura in cui l'ossigeno è intrappolato nella struttura della mioglobina nel citoplasma della cellula muscolare, la sua pressione intracellulare, determinata dall'ossigeno libero, rimane bassa.
La bassa pressione intracellulare di ossigeno mantiene il gradiente per l'ingresso di ossigeno sulla cellula. Ciò favorisce il passaggio dell'ossigeno dal torrente circolatorio alla cellula muscolare. Quando la mioglobina satura di ossigeno intracellulare aumenta, il che diminuisce progressivamente il gradiente e riduce quindi il trasferimento.
La curva di legame dell'ossigeno alla mioglobina è iperbolica. Nelle parti iniziali della curva, piccoli cambiamenti nella pressione parziale dell'ossigeno producono grandi cambiamenti nella saturazione della mioglobina con ossigeno.
Quindi, nella misura in cui la pressione parziale dell'ossigeno aumenta la saturazione continua ad aumentare, ma più lentamente, cioè è necessario un aumento molto maggiore della pressione parziale dell'ossigeno per aumentare la saturazione della mioglobina e progressivamente la curva si sta piatta.
Esiste una variabile che misura l'affinità della curva chiamata p50, ciò rappresenta la pressione parziale dell'ossigeno necessario per saturare la mioglobina contenuta del 50%. Quindi, se la P50 aumenta, si dice che la mioglobina ha meno affinità e se la P50 diminuisce, si dice che la mioglobina ha una maggiore affinità per l'ossigeno.
Può servirti: ProeritroBlast: caratteristiche, morfologia, regolazione, colorazioneQuando vengono esaminate le curve di legame all'ossigeno con mioglobina ed emoglobina, si osserva che per qualsiasi pressione parziale dell'ossigeno, la mioglobina è saturata piuttosto che emoglobina, indicando che la mioglobina ha una maggiore affinità per l'ossigeno rispetto all'ossigeno rispetto all'emoglobina.
Tipi di fibre muscolari e mioglobina
I muscoli scheletrici hanno diversi tipi di fibre muscolari nella loro composizione, alcune chiamate di contrazione lenta e altre di rapida contrazione. Le fibre di contrazione rapida sono adattate strutturalmente e metabolicamente ai contratti in modo rapido e vigoroso e in modo anaerobico.
Le fibre di contrazione lenta sono adattate per contrazioni a bassa velocità, ma più prolungate, tipiche degli esercizi di resistenza aerobica. Una delle differenze strutturali di queste fibre è la concentrazione di mioglobina, che dà loro il nome di fibre bianche e rosse.
Le fibre rosse hanno un alto contenuto di mioglobina, che dà loro il colore rosso, ma che consente anche di mantenere grandi quantità di ossigeno, che è indispensabile per la loro funzione.
Valori normali
I valori di sangue normali per gli uomini sono compresi tra 19 e 92 µg/L e nelle donne da 12 a 76 µg/L, tuttavia ci sono differenze nei valori nei diversi laboratori.
Questi valori aumentano quando la distruzione muscolare si verifica come nella rabdomiolisi del muscolo scheletrico, in ustioni estese, shock elettrici o in vasta necrosi muscolare dovuta all'occlusione arteriosa, nell'infarto miocardico e in alcuni miopatie.
In queste condizioni la mioglobina appare nelle urine e gli dà un colore caratteristico.

