Myofibrille Caratteristiche, struttura, composizione, funzioni
- 2914
- 746
- Rosolino Santoro
IL Miofibrille Sono le unità strutturali delle cellule muscolari, note anche come fibre muscolari. Sono molto abbondanti, sono fissi in parallelo e sono incorporati dal citosol di queste cellule.
Le cellule o le fibre muscolari strappate sono cellule molto lunghe, essendo in grado di misurare fino a 15 cm di lunghezza e da 10 a 100 μm di diametro. La sua membrana plasmatica è conosciuta come sarcolema e il suo citosol come sarcoplasma.
 Diagramma della struttura muscolare di un essere umano (fonte: DeGlr6328 ~ Commonswiki, via Wikimedia Commons)
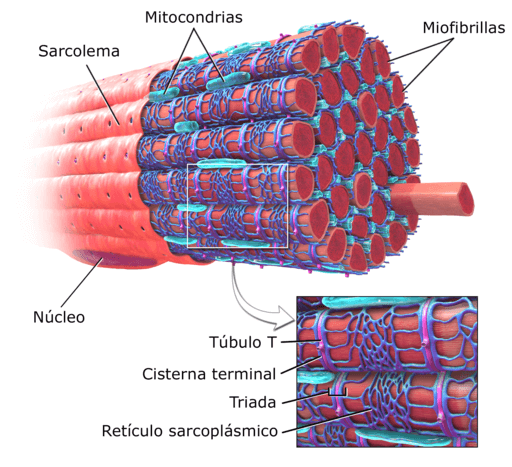
Diagramma della struttura muscolare di un essere umano (fonte: DeGlr6328 ~ Commonswiki, via Wikimedia Commons) All'interno di queste cellule si trovano, oltre alle miofibrille, più nuclei e mitocondri che sono noti come sarcosomi, nonché un prominente reticolo endoplasmatico noto come reticolo sarcoplasmatico.
I miofibrille sono riconosciuti come "elementi contrattili" dei muscoli negli animali vertebrati. Sono composti da vari tipi di proteine che sono quelli che danno loro le caratteristiche elastiche e retrattili. Inoltre, occupano una parte importante del sarcoplasma delle fibre muscolari.
[TOC]
Differenze tra le fibre muscolari
Esistono due tipi di fibre muscolari: fibre striate e lisce, ognuna con una distribuzione anatomica e una funzione specifica. I miofibrille sono particolarmente importanti ed evidenti nelle fibre muscolari striate che compongono il muscolo scheletrico.
Le fibre striate hanno un modello ripetitivo di bande trasversali quando vengono osservate su un microscopio e sono associate a muscoli scheletrici e parte della muscolatura cardiaca.
Le fibre lisce, al contrario, non presentano lo stesso modello al microscopio e si trovano nei muscoli caratteristici della vascolarizzazione e del sistema digestivo (e tutti i visceri).
Caratteristiche generali
I miofibrille sono composti da due tipi di filamenti contrattili (noti anche come miofilamenti), che a loro volta sono composti da proteine filamentose di miosina e actina, che saranno descritte in seguito.
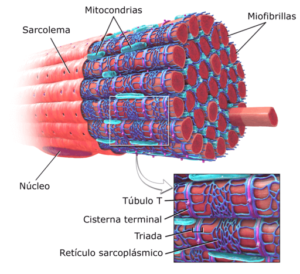 Rappresentazione grafica delle miofibrille nel muscolo scheletrico (Fonte: Brublaus modificato [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] via Wikimedia Commons)
Rappresentazione grafica delle miofibrille nel muscolo scheletrico (Fonte: Brublaus modificato [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] via Wikimedia Commons) Diversi ricercatori hanno stabilito che la vita media delle proteine contrattili delle miofibrille va da 5 giorni a 2 settimane, quindi il muscolo è un tessuto altamente dinamico, non solo dal punto di vista contrattile, ma della sintesi e del rinnovamento dei suoi elementi strutturali.
L'unità funzionale di ciascuna miofibrilla nelle cellule muscolari o nelle fibre è chiamata sarcomro ed è delimitata da una regione nota come "banda o linea z", da dove i miofilamenti dell'actina sono estesi in parallelo.
Poiché le miofibrille occupano una parte sostanziale del sarcoplasma, queste strutture fibrose limitano la posizione dei centri delle cellule a cui appartengono alla periferia dello stesso, vicino al sarcolema.
Può servirti: cellula umana: caratteristiche, funzioni, parti (organelli)Alcune patologie umane sono legate allo spostamento dei nuclei in travi miofibrillari, e queste sono conosciute come miopatie nucleari centrali.
Formazione di miofibrille o "miofibrillogenesi"
I primi miofil sono assemblati durante lo sviluppo del muscolo scheletrico embrionale.
Le proteine che compongono i sarcome (le unità funzionali delle miofibrille) sono inizialmente allineate dalle estremità e dai lati di un "premio" composto da filamenti di actina e piccole porzioni di miosina II non musulcolare e α-specifico dell'atto specifico del muscolo.
In questo modo, nelle fibre muscolari esprimono, in diverse proporzioni, i geni codificanti per le isoforme cardiache e scheletriche dell'α-actina. Innanzitutto la quantità di isoforma cardiaca che viene espressa è maggiore e quindi cambia allo scheletico.
Dopo la formazione del premio, le myofibrille nascenti sono assemblate dietro la zona di formazione del premio e in questi viene rilevata la forma della miosina muscolare II.
A questo punto, i filamenti di miosina sono allineati e complessi con altre proteine specifiche dell'Unione della miosina, che si verificano anche con i filamenti di actina.
Struttura e composizione
Come accennato un momento fa, le miofibrille sono composte da miofilamenti proteici contrattili: actina e miosina, che sono anche conosciute come miofilamenti sottili e spessi, rispettivamente. Questi sono visibili al microscopio ottico.
- Myofilaments sottili
I sottili filamenti di miofibrille sono costituiti da proteina di actina nella sua forma filamentosa (actina F), che è un polimero a forma globulare (actina G), che ha una dimensione inferiore.
I filamenti filamentosi di Actin G (Actin F) formano un doppio filamento che è avvolto in forma dell'elica. Ogni monomero di questi pesa più o meno 40 kDa ed è in grado di unirsi alla miosina in luoghi particolari.
Questi filamenti hanno un diametro di circa 7 nm e si estendono tra due aree conosciute come la banda I e la banda A. Nella banda A, questi filamenti si trovano attorno ai filamenti spessi che formano una disposizione esagonale secondaria.
In particolare, ogni filamento sottile è simmetricamente separato da tre filamenti spessi e ogni filamento spesso è circondato da sei filamenti sottili.
I filamenti sottili e spessi interagiscono tra loro attraverso "ponti incrociati" che si distinguono dai filamenti spessi e che appaiono nella struttura della miofibrilla a intervalli regolari di distanze vicino a 14 nm.
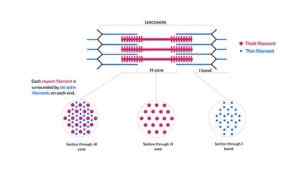 Rappresentazione schematica di miofilamenti che compongono i miofibrille e i loro tagli incrociati (Fonte: Kamran Maqsood 93 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons)
Rappresentazione schematica di miofilamenti che compongono i miofibrille e i loro tagli incrociati (Fonte: Kamran Maqsood 93 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons) I filamenti di actina e altre proteine associate si estendono sporgendo dai "bordi" delle linee Z e si sovrappongono ai filamenti di miosina verso il centro di ciascun sarcomero.
Può servirti: nutrizione cellulare: processo e nutrienti- Myofilamens spessi
I filamenti spessi sono polimeri della proteina miosina II (510 kDa ciascuno) e sono delimitati dalle regioni note come "bande A".
I miofilamenti di miosina sono lunghi circa 16 nm e sono distribuiti in disposizioni esagonali (se si osserva una sezione trasversale di un miofibrilla).
Ogni filamento di miosina II è costituito da molte molecole di miosina piena, ognuna delle quali è costituita da due catene polipeptidiche che hanno una regione o una "testa" sotto forma di una mazza e che si adattano in "mazzi" per formare i filamenti.
Entrambi i bundle sono sostenuti attraverso le loro estremità al centro di ogni sarcomero, in modo che le "teste" di ciascuna miosina siano dirette verso la linea Z, dove sono fissati i filamenti sottili.
Le teste di miosina svolgono funzioni molto importanti, poiché hanno siti sindacali per molecole ATP e, inoltre, durante la contrazione muscolare, sono in grado di formare i ponti incrociati per interagire con i sottili filamenti di actina.
- Proteine associate
I filamenti di actina sono "ancorati" o "fissa" alla membrana plasmatica delle fibre muscolari (sarcolema) grazie alla loro interazione con un'altra proteina nota come distrofina.
Inoltre, ci sono due importanti proteine dell'Unione Actin note come troponina e tropomiosina che, insieme a filamenti di actina, formano un complesso proteico. Entrambe le proteine sono essenziali per la regolazione delle interazioni che si svolgono tra filamenti sottili e spessi.
La tropomiosina è anche una molecola filamentaria a due livelli che è associata alle proporzioni di actina specificamente nella regione della scanalatura che si verificano tra i due fili. La troponina è un complesso proteico globulare tripartito disponibile a intervalli sui filamenti di actina.
Quest'ultimo complesso funziona come uno "interruttore" dipendente dal calcio che regola i processi di contrazione delle fibre muscolari, quindi è della massima importanza.
Nel muscolo striato di animali vertebrati, inoltre, ci sono altre due proteine che interagiscono con i filamenti spessi e sottili, noti rispettivamente come titina e nebulina.
La nebulina ha importanti funzioni nella regolamentazione della lunghezza dei filamenti di actina, mentre la titina partecipa al supporto e all'ancoraggio dei filamenti di miosina in una regione del sarcomero noto come linea M.
Altre proteine
Esistono altre proteine associate a mifilamenti spessi che sono conosciuti come la proteina C della miosina e dell'Unione della miomesina, che sono responsabili del fissaggio di filamenti di miosina nella linea M.
Può servirti: non autore: trasporto attraverso membrane, caratteristicheFunzioni
I miofibrille hanno implicazioni elementari nella capacità di spostare gli animali vertebrati.
Poiché sono costituiti da complessi proteici fibrosi e contrattili dell'apparato muscolare, questi sono essenziali per eseguire le risposte agli stimoli nervosi che portano a movimento e spostamento (nei muscoli striati scheletrici).
Le proprietà dinamiche indiscutibili del muscolo scheletrico, che includono oltre il 40% del peso corporeo, sono conferite dalle miofibrille che, allo stesso tempo, hanno il 70% delle proteine del corpo umano tra il 50 e il 70%.
I miofibrille, come parte di questi muscoli, partecipano a tutte le loro funzioni:
- Meccanica: Per convertire l'energia chimica in energia meccanica per generare resistenza, mantenere la postura, produrre movimenti, ecc.
- Metabolico: Poiché il muscolo partecipa al metabolismo dell'energia basale e funge da sito di stoccaggio di sostanze fondamentali come aminoacidi e carboidrati; Contribuisce inoltre alla produzione di calore e al consumo di energia e ossigeno utilizzato durante le attività fisiche o gli esercizi sportivi.
Poiché le miofibrille sono principalmente composte da proteine, queste rappresentano un sito di stoccaggio e rilascio di aminoacidi che contribuiscono al mantenimento dei livelli ematici di glucosio durante il digiuno o la fame.
Inoltre, la liberazione di aminoacidi da queste strutture muscolari ha la trascendenza dal punto di vista delle esigenze biosintetiche di altri tessuti come pelle, cervello, cuore e altri organi.
Riferimenti
- Despoulos, a., & Silbernagl, s. (2003). Atlante di colore di fisiologia (5 ° ed.). New York: thieme.
- Friedman, a. L., & Goldman, e. E. (millenovecentonovantasei). Caratterizzazione meccanica delle miofibrille muscolari scheletriche. Journal biofisico, 71(5), 2774-2785.
- Bordo, w. R., & Ochala, J. (2014). Muscolo scheletrico: una breve revisione della struttura e della funzione. Calcif Tissue Int, Quattro cinque(2), 183-195.
- Goldspink, g. (1970). La proliferazione delle miofibrille durante la crescita delle fibre muscolari. J. Cell SCT., 6, 593-603.
- Murray, r., Bender, d., Botham, k., Kennelly, p., Rodwell, v., & Weil, p. (2009). Biochimica illustrata di Harper (28 ° ed.). McGraw-Hill Medical.
- Rosen, J. N., & Baylies, M. K. (2017). Myofibrille Metti la stretta sui nuclei. Biologia cellulare della natura, 19(10).
- Sanger, j., Wangs, j., Fan, e., Bianco, J., Mi-my, l., Dube, d.,... Pruyne, D. (2016). Assemblaggio e mantenimento delle miofibrille nei muscoli striade. In Manuale di farmacologia sperimentale (P. 37). New York, USA: Springer International Publishing Svizzera.
- Sanger, j. W., Wang, J., Fan, e., Bianco, J., & Sanger, J. M. (2010). Assemblaggio e dinamica delle miofibrille. Journal of Biomedicine and Biotechnology, 2010, 8.
- Sobieszek, a., & Bremel, R. (1975). Preparazione e proprietà di vertebrato liscio - miofibrille muscolari e actomiosina. European Journal of Biochemistry, 55(1), 49-60.
- Villee, c., Walker, w., & Smith, F. (1963). Zoologia generale (2nd ed.). Londra: W. B. Saunders Company.
- « Caratteristiche della lobelia, habitat, distribuzione, specie
- Caratteristiche cefalopodi, habitat, riproduzione, nutrizione »

