Caratteristiche della mieloperossidasi, struttura, funzioni
- 1237
- 210
- Brigitta Ferrari
IL mieloperossidasi È un'emoproteina con attività enzimatica ossidortetta che funziona in diverse cellule del sistema immunitario nel combattimento di microrganismi invasori e in altri processi cellulari.
Questa perossidasi lisosomiale si trova nei granulociti e nei monociti di mammiferi ed esercitano funzioni nel sistema di microbicidi dipendenti dal perossido di idrogeno dei neutrofili, essendo parte dei componenti dell'innata immune risposta.
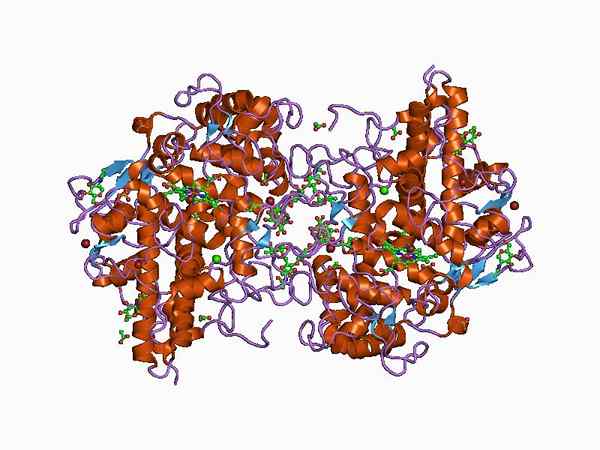
 Rappresentazione della struttura dell'enzima mieloperossidasi (Fonte: Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [Dominio pubblico] tramite Wikimedia Commons)
Rappresentazione della struttura dell'enzima mieloperossidasi (Fonte: Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [Dominio pubblico] tramite Wikimedia Commons) È stato descritto per la prima volta da Agner, che ha coniato il periodo iniziale di "Verdoperossidasi", in quanto è un enzima con un caratteristico colore verde.
Qualche tempo dopo il suo nome è stato cambiato in mieloperossidasi, poiché è un enzima caratteristico delle cellule appartenenti a lignaggi mieloidi dal midollo osseo e presente in diversi tessuti connettivi del corpo di alcuni animali.
Oltre alle sue funzioni nel sistema immunitario per il combattimento di microrganismi invasori, i prodotti delle reazioni catalizzate dalla mieloperossidasi causano danni ai tessuti durante le diverse reazioni infiammatorie.
La sua attività è stata anche correlata all'evoluzione di alcune malattie cardiovascolari e durante le fasi di iniziazione, propagazione e complicazione dei processi aterosclerotici, che viene sfruttato per la diagnosi e l'intervento terapeutico di queste patologie.
[TOC]
Caratteristiche
La funzione catalitica della mieloperossidasi si basa sull'ossidazione di due elettroni del clima, per ottenere la formazione di hocl o acido ipocloroso che, quando ingerito dagli organismi viventi, è tossico e può persino essere letale.
Questo enzima è particolarmente abbondante nei granuli azurophilici primari nel citoplasma dei leucociti polimorfonucleari, dove rappresenta più del 3% del peso. Si trova anche nei monociti umani, ma non nei macrofagi tissutali.
Può servirti: Woese Classification (3 Domain System)La mieloperossidasi è codificata da un gene 2.200 coppie di basi (2.2 kb), che è responsabile della sintesi di un peptide precursore di 745 rifiuti aminoacei.
Nell'uomo, questo gene si trova sul cromosoma 17, nella regione 12-23 del braccio lungo e contiene 12 esoni e 11 introni.
La sintesi di questa proteina si verifica nella fase promielocitica della differenziazione delle cellule del lignaggio mieloide e la loro elaborazione post-traslazionale si verificano tra il reticolo endoplasmatico, il complesso del Golgi e la membrana plasmatica.
L'incorporazione del gruppo di protesi emo si verifica indipendentemente dall'elaborazione post-traslazionale della proteina precursore inattiva.
Struttura
La mieloperossidasi è sintetizzata come una proteina precursore glicosilata (con porzioni di carboidrati) di circa 90 kDa. Questo è successivamente diviso per formare due catene: una pesante (55-60 kDa) e una luce (10-15 kDa).
La proteina matura è composta da due catene pesanti e due leggere, che formano un tetler da 120 a 160 kDa, con due gruppi protesici identici in ogni tetro.
La catena pesante ha 467 aminoacidi ed è all'estremità C-terminale della proteina, mentre la catena leggera è costituita da 108 rifiuti.
Nei leucociti polimorfonucleari, sono state descritte almeno tre isoforme di questo enzima, note come I, II e III e nelle cellule promielocitiche tumorali HL-60 (cellule precursori) quattro sono state descritte quattro, chiamate AI, Ib, II e III.
Le mieloperossidasi di tipo I, II e III di polimorfonucleare hanno pesi molecolari di 120, 115 e 110 kDa, rispettivamente e la loro composizione di aminoacidi non varia considerevolmente. Hanno un'alta percentuale di rifiuti di aspartato, glutammato, leucina e prolina, nonché Aminoazúcar N-acetilglucosamina nella porzione di Sacararida.
Può servirti: ossidazione beta di acidi grassi: passaggi, reazioni, prodotti, regolazioneIl gruppo protesico di questi enzimi contiene atomi di ferro e il contenuto di questo metallo varia a seconda delle specie animali studiate. Si pensa che questo gruppo sia covalentemente legato alle subunità pesanti della struttura, che è importante per l'attività enzimatica.
Funzioni
La mieloperossidasi fa parte di quello che è noto il "sistema mieloperossidasi" e agisce durante la fagocitosi dei microrganismi invasori, che è accompagnato da varie reazioni ossidative, essendo parte dei vacuoli fagocitici.
Questo sistema mieloperossidasi è coinvolto nell'eliminazione di batteri, virus, parassiti e funghi.
I componenti del sistema sono enzimi mieloperossidasi, perossido di idrogeno e un fattore ossidabile come un haluro. Il perossido di idrogeno viene prodotto durante la respirazione attraverso gli anioni di superxidi intermediari.
Questo perossido è in grado di reagire con la mieloperossidasi per formare ciò che è noto come composto I, che può "attaccare" diversi Haluros. Quando il composto I reagisce con altre molecole di donatori di elettroni, diventa composto II, ma questo non è in grado di reagire con Haluros.
Gli haluros che il composto che uso può essere cloruri, bromuri, iodidi e lo pseudo haluro tiociarato; Il più comune per questi enzimi, secondo gli esperimenti In vivo, Sono i cloruri che, una volta elaborati dalla mieloperossidasi, vengono trasformati in acido ipocloroso e altri derivati, che sono potenti molecole "germicide".
Altre reazioni catalizzate dallo stesso enzima producono radicali idrossilici liberi, atomi di ossigeno "singoletto", che non sono altro che atomi di ossigeno in uno stato eccitato e di ozono (O3), tutti con attività battericide.
Può servirti: lia agar (ferro lisina): cosa è, base, preparazione, usiNello sviluppo delle malattie
L'enzima mieloperossidasi è coinvolto nella promozione e nella propagazione dell'aterosclerosi, poiché amplifica il potenziale ossidativo del perossido di idrogeno producendo potenti ossidanti in grado di influenzare diversi composti fenolici.
Queste specie reattive sono coinvolte nella comparsa di lesioni tissutali che si verificano durante una varietà di condizioni infiammatorie.
L'aumento dei livelli sistemici di questo enzima è usato come marcatore diagnostico dell'esistenza di malattia coronarica e altre importanti condizioni cardiache.
Oltre alla loro relazione con alcune malattie cardiache, i difetti nella mieloperossidasi si traducono anche in condizioni patologiche immunitarie, poiché i difetti nella loro attività battericida possono provocare infezioni sistemiche pericolose e acute.
Riferimenti
- Kimura, s., & Ikeda-saito, m. (1988). Myeloperossidae umana e perossidasi tiroidea, due enzimi con funzioni fisiologiche separate e distinte, sono membri correlati evolutivi della stessa famiglia genica genica. Proteine: struttura, funzione e bioinformatica, 3, 113-120.
- Klebanoff, s. J. (1999). Myeloperoxidae. Sistemi antimicrobici di fagociti, 111(5), 383-389.
- Klebanoff, s. J. (2005). Myeloperoxidae: amico e nemico. Journal of Leukocite Biology, 77, 598-625.
- Koeffler, p., Ranyard, J., & Pertcheck, M. (1985). Myeloperoxidae: la sua struttura ed espressione durante la differenziazione mieloide. Sangue, 65(2), 484-491.
- Nicholls, s. J., Hazen, s. L., Nicholls, s. J., & Hazen, s. L. (2005). Mieloperossidae e malattie cardiovascolari. Arteriosclerosi, trombosi e biologia vascolare, 25, 1102-1111.
- Tobler, a., & Koefter, H. P. (1991). Myeloperoxidae: localizzazione, struttura e funzione. In Biochimica delle cellule del sangue (pp. 255-288). New York: Plenum Press.

