Massa molare come viene calcolato, esempi ed esercizi risolti
- 1551
- 321
- Benedetta Rinaldi
IL Massa molare È una proprietà intensiva della materia che mette in relazione il concetto di mol e misurazioni di massa. Essendo più conciso, è la quantità di massa corrispondente a una moli di sostanza; Cioè, ciò che "pesa" un numero di Avogadro (6.022 · 1023) di alcune particelle.
Una mole di qualsiasi sostanza conterrà lo stesso numero di particelle (ioni, molecole, atomi, ecc.); Tuttavia, la sua massa varierà perché le sue dimensioni molecolari sono definite dal numero di atomi e isotopi che compongono la sua struttura. Più massa è l'atomo o la molecola, più grande la sua massa molare.
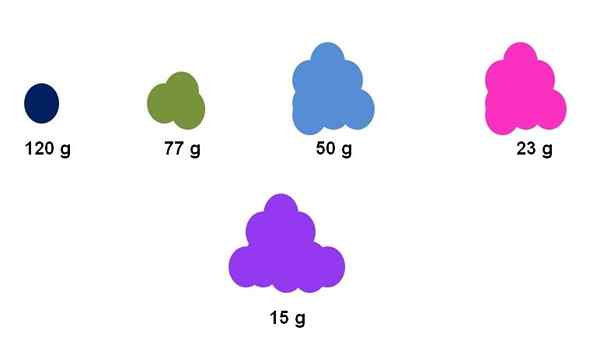
 La differenza tra le masse molari di varie sostanze può essere notata superficialmente dalla quantità apparente del loro campione. Fonte: Gabriel Bolívar.
La differenza tra le masse molari di varie sostanze può essere notata superficialmente dalla quantità apparente del loro campione. Fonte: Gabriel Bolívar. Ad esempio, supponiamo che esattamente una mol si incontri per cinque diversi composti (immagine superiore). Usando un equilibrio, l'impasto è stato misurato per ciascun cluster, espresso di seguito. Questa massa corrisponde all'impasto molare. Di tutti loro, il composto viola è quello con le particelle più chiare, mentre il composto blu scuro, le particelle più pesanti.
Si noti che è mostrata una tendenza generalizzata ed esagerata: maggiore è la massa molare, minore è la quantità di campione che deve essere posizionata in bilancia. Tuttavia, questo volume di materia dipende anche molto dallo stato di aggregazione di ciascun composto e dalla sua densità.
[TOC]
Come viene calcolato l'impasto molare?

Definizione
La massa molare può essere calcolata dalla sua definizione: quantità di massa per mole di sostanza:
M = grammi di sostanza /mol di sostanza
In effetti, g/mol è l'unità in cui viene generalmente espressa la massa molare, accanto a kg/mol. Pertanto, se sappiamo quante moli abbiamo di un composto o di un elemento e lo peseremo, raggiungeremo la sua massa molare applicando una semplice divisione.
Può servirti: Justus von LiebigElementi
La massa molare non si applica solo ai composti, ma anche agli elementi. Il concetto di moli non discrimina affatto. Pertanto, con l'aiuto di una tavola periodica posizioniamo le masse atomiche relative per un elemento di interesse e moltiplichiamo il suo valore per 1 g/mol; Questo è, costante di Avogadro, MO.
Ad esempio, la massa atomica relativa dello stronzio è di 87,62. Se vogliamo avere la sua massa atomica, sarebbe 87,62 Uma; Ma se ciò che stiamo cercando è la sua massa molare, allora sarà 87,62 g/mol (87,62 · 1g/mol). E così, le masse molari di tutti gli altri elementi sono ottenuti allo stesso modo, senza nemmeno fare tale moltiplicazione.
Composti
La massa molare di un composto non è altro che la somma delle masse atomiche relative dei suoi atomi moltiplicati per MO.
Ad esempio, la molecola d'acqua, H2Oppure ha tre atomi: due di idrogeno e uno di ossigeno. Le masse atomiche relative di H e O sono rispettivamente 1.008 e 15.999. Pertanto, aggiungiamo le sue masse che si moltiplicano per il numero di atomo presente nella molecola composta:
2 H · (1.008) = 2.016
1 O · (15.999) = 15.999
M(H2O) = (2.016 + 15.999) · 1g/mol = 18.015 g/mol
È una pratica abbastanza comune da omettere MO alla fine:
M(H2O) = (2.016 + 15.999) = 18.015 g/mol
Resta inteso che l'impasto molare ha unità di g/mol.
Esempi
Una delle masse molari più conosciute è appena stata menzionata: l'acqua, 18 g/mol. Coloro che hanno familiarità con questi calcoli, raggiungono un punto in cui sono in grado di memorizzare alcune masse molari senza cercarle o calcolarle come è stato fatto. Alcune di queste masse molari, che servono come esempi, sono le seguenti:
Può servirti: vantaggi e svantaggi della chimica della salute-O2: 32 g/mol
-N2: 28 g/mol
-NH3: 17 g/mol
-Cap4: 16 g/mol
-Co2: 44 g/mol
-HCL: 36,5 g/mol
-H2SW4: 98 g/mol
-Cap3COOH: 60 g/mol
-Fede: 56 g/mol
Si noti che i valori dati sono arrotondati. Per scopi più precisi, le masse molari con più decimale devono essere espresse e calcolate con masse atomiche relative dovute ed esatte.
Esercizi risolti
Esercizio 1
Attraverso metodi analitici, è stato stimato che una soluzione campione contiene 0,0267 moli di un analita D. È anche noto che la sua massa corrisponde al 14% di un campione la cui massa totale è di 76 grammi. Calcola la massa molare del presunto analita d.
Dobbiamo determinare la massa di d che viene sciolta nella soluzione. Procediamo:
Massa (d) = 76 g · 0,14 = 10,64 g D
Cioè, calcoliamo il 14% dei 76 grammi del campione, che corrispondono ai grammi dell'analita D. Quindi, e infine, applichiamo la definizione della massa molare, poiché abbiamo dati sufficienti per calcolarla:
M(D) = 10,64 g D/ 0,0267 moli D
= 398,50 g/mol
Cosa si traduce come: uno mol (6.022 · 1023) Da e ha una massa pari a 398,50 grammi. Grazie a questo valore possiamo sapere quanto di e vogliamo pesare sull'equilibrio nel caso in cui desideriamo, ad esempio, preparare una soluzione di una concentrazione molare di 5 · 10-3 M; Cioè, sciogliere 0,1993 grammi di e in un litro di solvente:
5 · 10-3 (mol/L) · (398,50 g/mol) = 0,1993 g e
Esercizio 2
Calcola la massa molare dell'acido citrico sapendo che la sua formula molecolare è C6H8O7.
La stessa formula C6H8O7 Facilita la comprensione del calcolo, poiché ci dice una volta che il numero di atomi di C, H e o che ci siano in acido agrumi. Pertanto, ripetiamo lo stesso passaggio fatto per l'acqua:
Può servirti: dodecil sodio solfato (SDS): struttura, proprietà, usi6 C · (12.0107) = 72.0642
8 H · (1.008) = 8.064
7 O · (15.999) = 111.993
M(acido citrico) = 72.0642 + 8.064 + 111.993
= 192.1212 g/mol
Esercizio 3
Calcola l'impasto molare di solfato di rame pentaidrato, CUO4· 5h2O.
Sappiamo prima che la massa molare dell'acqua sia di 18.015 g/mol. Questo serve a semplificare i calcoli, perché lo omettiamo per il momento e ci concentriamo sul sale anidro CUO4.
Abbiamo che le masse atomiche relative di rame e zolfo sono rispettivamente 63.546 e 32.065. Con questi dati, procediamo allo stesso modo dell'esercizio 2:
1 Cu · (63.546) = 63.546
1 S · (32.065) = 32.065
4 O · (15.999) = 63.996
M(Cuso4) = 63.546 + 32.065 + 63.996
= 159.607 g/mol
Ma siamo interessati all'impasto molare di sale pentaidrato, non agli anidri. Per fare ciò, dobbiamo aggiungere al risultato la massa corrispondente dell'acqua:
5 h2O = 5 · (18.015) = 90,075
M(Cuso4· 5h2O) = 159.607 + 90.075
= 249.682 g/mol
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Wikipedia. (2020). Massa molare. Recuperato da: in.Wikipedia.org
- Nissa Garcia. (2020). Cos'è la massa molare? Definizione, formula ed esami. Studio. Recuperato da: studio.com
- Dottore. Kristy m. Bailey. (S.F.). Tutorial di stechiometria
Trovare massa molare. Estratto da: OCC.Edu - Helmestine, Anne Marie, PH.D. (2 dicembre 2019). Problema di esempio di massa molare. Recuperato da: Thoughtco.com
- « Discovery, struttura, proprietà, proprietà di Darmstadtio
- Acqua o fasi del ciclo idrologico e importanza »

